Thymome und Myasthenia
ThoraxchirurgieDer Thymus gilt als zentrales lymphatisches Organ und ist von zentraler Bedeutung für die Selektion von T-Lymphozyten (spezielle Abwehrzellen). Im Thymus werden unreife T-Lymphozytenvorläuferzellen aus dem Knochenmark durch positive und negative Selektion aussortiert und zu fertigen T-Lymphozyten geschult. Diese Selektionierung ist abhängig von MHC-Molekülen und dem spezifischen Antigen.
Thymome sind seltene maligne Tumoren und repräsentieren etwa 0,2 – 1,5 % aller Malignome. In etwa 50 % der Fälle ist die Ursache für einen Tumor im vorderen Mediastinum ein Thymom. 10 – 15 % der Patienten mit Myasthenia gravis weisen ein Thymom auf. Umgekehrt kann bei etwa 45 % der Patienten mit einem Thymom eine Myasthenia gravis nachgewiesen werden. Bis heute ist der Zusammenhang zwischen dieser Autoimmunkrankheit und dem Auftreten eines Thymoms nicht eindeutig geklärt. Andere Autoimmunkrankheiten, die mit einem Thymom einhergehen können und in mehr als 2 % der Thymome auftreten, sind die Hypogammaglobulinämie, Red blood cell aplasia, Lupus erythematosus, Polymyositis, Agranulozytose, die rheumatoide Arthitis und der M. Cushing.
Thymome treten bei Männern und Frauen etwa gleich häufig auf, die meisten Patienten sind zum Zeitpunkt der Diagnosestellung zwischen 40 und 60 Jahre alt.
Auch wenn in der Literatur zahlreiche Klassifikationssysteme für die Thymome genannt werden, so haben sich für den klinischen Alltag lediglich die Masaoka-Einteilung und die WHO-Klassifikation als nützlich erwiesen. Diese beiden Klassifikationen entscheiden über Therapie und Prognose des Patienten. Entscheidend bei der Behandlung und Beurteilung des Krankheitsverlaufs des Thymoms ist die Feststellung, dass es sich bei allen Thymomen immer um ein Malignom handelt und in Abhängigkeit des Stadiums Rezidive und Fernmetastasen auftreten können.
Welche Arten von Thymustumoren gibt es und wie werden diese aus medizinischer Sicht eingeteilt?
Prinzipiell sind alle Thymome, unabhängig von dem klinisch-histologischen Stadium, als bösartig einzustufen. Das liegt daran, dass alle - auch die scheinbar gutartigen Tumore - bösartig entarten können. Die verschiedenen etablierten Klassifikationssysteme sollen dem Kliniker helfen, die Prognose abzuschätzen und Missverständnisse bezüglich der erforderlichen Therapie zu vermeiden. Grundsätzlich wird dabei - etwas vereinfacht - das Thymom von dem sehr bösartigen Thymuskarzinom unterschieden.
Die Klassifikationssysteme beziehen entweder das feingewebliche Zellbild (Histologie) des Tumors ein oder berücksichtigen den Ausbreitungsgrad im Mediastinum und das Vorhandensein von Absiedlungen (Tochtergeschwülste) bzw. von Lymphknotenmetastasen. Es werden hauptsächlich zwei Klassifikationen angewendet: Einerseits das WHO-System, andererseits die Masaoka-Klassifikation. Die Einteilung der Tumore nach der Weltgesundheitsorganisations-Klassifikation (WHO) nach verschiedenen Zelltypen (histologische Klassifikation) ist aufgrund der fehlenden klinischen Wichtigkeit von untergeordneter Bedeutung. In der klinischen Praxis hat sich aufgrund der guten Einschätzung des zu erwartenden Verlaufs sowie der Überlebenschancen des Patienten die so genannte Masaoka-Klassifikation bewährt. Die Masaoka-Klassifikation ist eine klinische Einteilung der Thymome in vier Stadien, wobei Stadium I das Stadium mit der besten Prognose und Stadium IV das mit der schlechtesten Prognose darstellt. Eine genaue Übersicht über die einzelnen Stadien gibt Tabelle 1.
| I | Vollständig umkapselter Tumor |
| II | Tumor durchbricht die Kapsel mit Einbruch in das umgebende Fettgewebe bis zum Brustfell |
| III | Tumor durchbricht das Brustfell oder den Herzbeutel oder bricht in benachbarte Organe (Lunge, große Gefäße) ein |
| IV a | pleurale und perikardiale Ausbreitung |
| IV b | Fernmetastasen |
Symptome
Die Beschwerden, welche bei einem Thymom auftreten können, zeigen sich bei den meisten Patienten erst in fortgeschrittenen Stadien. 30 % der Patienten zeigen bei Diagnosestellung keine Beschwerden. In der Regel entstehen diese Beschwerden, weil der Tumor in das Nachbargewebe einwächst bzw. benachbarte Strukturen zunehmend verdrängt. Dabei kann es sich im Einzelnen um folgende Symptome handeln:
- Druckgefühl hinter dem Brustbein
- Atemnot (die Luftröhre ist verengt)
- Schluckbeschwerden (Druck auf die Speiseröhre)
- Heiserkeit (so genannte Recurrensparese); ursächlich liegt dabei eine Lähmung des Stimmnervs (Nervus laryngeus inferior) zugrunde
- Obere Einflussstauung (die obere Hohlvene wird durch den Tumor zusammen gepresst und dadurch der Blutrückfluss aus dem Kopf und den Armen zum Herzen behindert)
- Herzfunktionsstörungen (Tumormasse drückt auf das Herz)
- Gemeinsames Auftreten mit speziellen Erkrankungen (z. B. Myasthenia gravis)
- Brustkorbschmerzen
- Husten
- Luftnot (Dyspnoe)
40 % der Beschwerden sind durch die große Tumormasse im Brustkorb bedingt. Von allen Patienten mit einem Thymom haben 30 % nicht nur lokale, sondern auch systemische Beschwerden (betrifft den ganzen Körper). Die häufigsten Beschwerden sind Brustkorbschmerzen, Husten und schwere Luftnot.
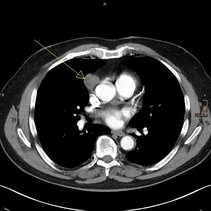
Abb. 1: Computertomographie des Brustkorbs (Weichteiltechnik) mit Darstellung eines Thymoms (gelber Pfeil) im Mediastinum eines männlichen Patienten vor der operativen Entfernung.
Diagnose
Die Diagnose eines Thymoms wird meist zufällig im Rahmen einer Routineuntersuchung (Röntgen-Thorax) gestellt. Oftmals haben die Patienten mehrere Arztbesuche hinter sich, da die Beschwerden meist unspezifisch sind.
Es sollte beim Verdacht auf ein Thymom immer ein Röntgenbild des Brustkorbs in zwei Ebenen angefertigt werden. Dabei ist sowohl von vorn als auch von der Seite eine Röntgenaufnahme des Brustkorbs erforderlich. Besteht der Verdacht auf ein Geschwür der Thymusdrüse, ist eine Schichtaufnahme des Brustkorbs (Computertomographie, CT) zwingend erforderlich (Abb. 1). Um einen etwaigen Befall benachbarter Strukturen (Lungenfell, Lunge, Herzbeutel, Speiseröhre, Halsweichteile) besser abschätzen zu können, ist in Einzelfällen eine Kernspintomographie (Magnetresonanztomographie, MRT) erforderlich. Dabei kann durch diese spezielle Untersuchungsmethode das umgebende Weichteilgewebe genau dargestellt und so das Ausmaß beurteilt werden.
Bei einer Geschwulst im Mediastinum kann es sich neben einem Thymom auch um andere Tumorarten handeln. Als Alternative muss immer an ein Lymphom (Lymphdrüsenkrebs) oder an einen bösartigen Tumor der Keimzellen (embryonaler Tumor) gedacht werden. Deshalb ist vor einer Behandlung die genaue Klärung der Tumorart anzustreben. Dies ist nur durch eine feingewebliche Untersuchung endgültig zu klären, für die eine Gewebeprobe (Biopsie) gewonnen werden sollte. Da es durch die Lage der Thymusdrüse oftmals schwierig ist, eine Gewebeprobe zu entnehmen, sollten Patienten mit einem solchen Tumor schnellstmöglich einem spezialisierten Thoraxchirurgen vorgestellt werden.
Therapie
Der Goldstandard der Therapie bei chirurgisch vollständig entfernbaren Thymomen ist die Operation. Dabei ist aus onkologischer Sicht für das Überleben der Patienten der wichtigste beeinflussende Faktor die Entfernung des Tumors im Gesunden (R0-Resektion).Dabei müssen alle dem Thymom anhängenden Strukturen mitentfernt werden. Bei der Operation wird das Restthymusgewebe sowie die umgebenden Lymphknoten und alle Fett- und Bindegewebsbestandteile entfernt. Insgesamt sinkt die Möglichkeit einer kompletten Tumorentfernung mit dem höheren, im vorangehenden Absatz beschriebenen Masaoka-Stadium. Bei Patienten im Stadium I kann in 100 % der Fälle eine komplette Tumorresektion erzielt werden. Bei Thymomen im Stadium IV ist eine völlige Entfernung nur in unter 30 % der Fälle möglich.
Die Operation des Thymus kann über verschiedene Zugangswege erfolgen und richtet sich nach Tumorausdehnung und -größe. Der am häufigsten erforderliche Zugangsweg ist die Eröffnung des Brustbeins (Sternotomie). Wenn man sich die Überlebensraten der Patienten im Hinblick auf die verschiedenen Zugangswege anschaut, muss aufgrund der guten Sicht und der Möglichkeit, alles Gewebe inklusive Lymphknoten zu entfernen (Radikalität), die so genannte mediane Sternotomie (längsseitige Durchtrennung des Brustbeins) als Standard-Zugang empfohlen werden. In Einzelfällen ist auch die seitliche Eröffnung des Brustkorbs (laterale Thorakotomie) sowie bei sehr kleinen Thymomen (< 4 cm im Durchmesser) eine Entfernung der Thymusdrüse in Schlüssellochtechnik (videoassistierte Operation) möglich.
Eine weitere Behandlungsmöglichkeit bietet die Hypertherme intrathorakale Chemotherapie (HITOC).
Ist eine Entfernung aller Lymphdrüsen in diesem Gebiet erforderlich?
Die Entfernung aller Lymphknoten in dem Abflussgebiet des Tumors (radikale Lymphknotendissektion) ist nur bei Thymuskarzinomen (spezieller Tumortyp, WHO-Typ C) zwingend erforderlich und verbessert ganz klar das Überleben des Patienten. Insgesamt setzen Thymome sehr selten Lymphknotenmetastasen. Die Wahrscheinlichkeit wird mit 1,8 % angegeben und hat keinen Einfluss auf das Überleben. In allen Fällen müssen aber sichtbare, krankhaft vergrößerte Lymphknoten entfernt werden.
Ist eine Bestrahlung nach der Operation erforderlich?
Der Stellenwert der Strahlentherapie ist bei diesem Tumortyp nicht unstrittig, da es aufgrund der Seltenheit nur sehr wenige Zentren mit der entsprechenden Erfahrung gibt. Insgesamt reagieren Thymome gut auf eine Strahlentherapie und zeigen ein gutes Ansprechen. Patienten im Masaoka Stadium III profitieren deutlich von einer anschließenden Bestrahlung und deshalb sollte sie den Patienten zur Senkung der Lokalrezidivrate unbedingt angeboten werden. Ein Lokalrezidiv wird durch die Strahlentherapie gut erfasst und lässt eine lokale Bestrahlung sinnvoll erscheinen. Kann ein Thymom nicht komplett im Gesunden entfernt werden, muss unbedingt eine Bestrahlung des Operationsfeldes erfolgen.
Ist eine Chemotherapie erforderlich?
Prinzipiell reagieren Thymome empfindlich auf eine Chemotherapie (chemosensibel). Es existieren aber aktuell keine überzeugenden Daten, die den routinemäßigen Einsatz einer Chemotherapie unterstützen würden.
Bei lokal fortgeschrittenen und daher chirurgisch primär nicht vollständig entfernbaren Tymomen, kann eine Chemotherapie vor einer Operation sehr hilfreich sein, wenn hierdurch eine Tumorverkleinerung erreicht werden kann und somit nachfolgend eine vollständige chirurgisch Entfernung des Tumors möglich wird.
Bei Vorliegen einer begrenzten Metastasierung auf eine Brustkorbhälfte, kann in einzelnen Fällen eine Kombinationsbehandlung aus Operation und Chemotherapie sinnvoll sein.
Bei Nachweis von Metastasen auch außerhalb des Brustkorbes ist eine Chemotherapie erforderlich.
Wie sind der Verlauf und das Überleben (Prognose) bei Thymomen?
Insgesamt ist die Prognose bei Thymomen gut, am besten ist sie bei einem vollständig abgekapselten und komplett entfernten Tumor, der nicht weit ausgedehnt war. In manchen Fällen kann das Thymom nicht vollständig entfernt werden, da der Tumorbefall zu ausgedehnt ist. Eine Operation ist aber auch dann sinnvoll, da durch die Reduktion der Tumormasse (Reduktion der Tumorlast) das Überleben der Patienten ebenfalls verbessert werden kann. Im Anschluss muss dann aber eine Nachbestrahlung erfolgen. Die 5-Jahres-Überlebensrate ist bei Thymomen mit etwas über 80 % hoch. Insgesamt wird das Überleben dabei stark von dem lokalen Wachstumsverhalten sowie dem etwaigen Auftreten eines erneuten Thymoms (Rezidiv) beeinflusst. Nur in sehr wenigen Fällen (9 %) treten Tochtergeschwülste auf, weshalb die lokale Tumorentfernung im Vordergrund steht. Es gibt insgesamt einige wichtige Faktoren, die das Überleben positiv beeinflussen (Prognosefaktoren). Dazu gehören die Entfernung des Tumors im Gesunden, ein niedriges Masaoka-Stadium und das Vorhandensein einer Kapsel.
Kann man der Entstehung von Thymomen vorbeugen?
Wie bei vielen anderen Tumorarten gibt es auch bei Thymomen keine verlässlichen Methoden, die der Entstehung vorbeugen könnten. Inwieweit eine familiäre Häufung und damit eine genetische Veranlagung (genetische Disposition) vorliegt, ist unklar.
Mit welchen anderen Erkrankungen kann ein Thymom auftreten?
Thymome können typischerweise mit bestimmten Erkrankungen vermehrt auftreten. Dabei ist insbesondere eine Autoimmunerkrankung, die so genannte Myasthenia gravis, zu nennen. Außerdem kann ein Thymom mit einer Blutarmut (Pur Red Cell Aplasie), mit einer Hypogammaglobulinämie, einer Antikörpermangelerkrankung, oder mit anderen Erkrankungen des autoimmunen Formenkreises (rtheumatoide Erkrankungen) auftreten. Diese Erkrankungsbilder werden unter dem Bergriff der parathymischen Syndrome zusammengefasst. Insgesamt ist nicht genau bekannt, warum ein Thymom zusammen mit den oben genannten Erkrankungen auftreten kann.
Wie ist der Zusammenhang zwischen Myasthenia gravis und Thymom?
Bei Patienten mit einer Myasthenie findet sich in ca. 10 - 15% der Fälle ein Thymom, umgekehrt kann bei ca. 45% der Patienten mit einem Thymom eine Myasthenie gefunden werden. Bis heute ist der Zusammenhang zwischen dieser Autoimmunerkrankung und dem Auftreten des Thymoms nicht eindeutig geklärt. Andere Autoimmunerkrankungen aus dem parathymischen Formenkreis treten in etwas mehr als 2% der Fälle auf. Dabei handelt es sich in den meisten Fällen um fehlgerichtete Autoantikörper, die sich gegen körpereigenes Gewebe richten und dort einen Schaden verursachen.
Bei der Myasthenia gravis im Speziellen finden sich in der Thymusdrüse in der überwiegenden Mehrzahl der Fälle krankhafte Veränderungen und scheinen deshalb eine zentrale Rolle bei der Initiierung dieser Autoimmunerkrankung zu spielen. Im Fall der Myasthenie ist ein spezifischer Autoantikörper gegen den so genannten Acetylcholinrezeptor nachweisbar. Dies ist aber nicht bei allen Patienten mit einer Myasthenie möglich, so dass medizinisch eine Myasthenie mit Antikörpernachweis (seropositive Myasthenie) und eine ohne Autoantikörpernachweis (seronegative Myasthenie) unterschieden werden muss. Dieser Rezeptor regelt die Übertragung von Nervenimpulsen an den Verbindungsstellen zwischen Nerven und Muskelzellen (motorische Endplatte). Durch die Autoantikörper wird dieser Rezeptor zerstört, so dass dort eine Übertragungsstörung vorliegt. Es resultiert eine muskuläre Schwäche, die prinzipiell alle Muskelgruppen betreffen kann. Beschwerden, die auf eine Myasthenie hinweisen können, sind Doppelbilder, Kau- und Schluckbeschwerden, eine Gewichtsabnahme sowie eine sehr schnelle Ermüdung insbesondere der großen körpernahen Muskelgruppen (Quadrizeps, Bizeps). Hängende Augenlieder oder Sehschwächen sind oft die ersten Symptome. Im schlimmsten Fall kann diese Erkrankung zum Ausfall der Atemmuskeln mit folgender künstlicher Beatmung führen. Eine Zunahme der Beschwerden findet sich meist in der zweiten Tageshälfte.
Nach der Entfernung der Thymusdrüse bzw. des Thymoms (Resektion) sind diese Beschwerden in den meisten Fällen rückläufig sowie selbstlimitierend. Deswegen wird neben der medikamentösen Therapie mit speziellen Medikamenten (Mestinon, Kortison) die Tumorresektion empfohlen. Patienten mit einer so genannten seronegativen Myasthenia gravis ohne nachweisbaren Autoantikörper gegen diese Acetylcholinrezeptoren im Labor scheinen nicht von einer Thymusresektion zu profitieren. In jedem Fall sollte aber ein Neurologe mit in die Behandlung einbezogen werden und der Patient vor einer Operation keine myastenen Beschwerden aufweisen. Unsere Klinik für Thoraxchirurgie ist Kooperationspartner des seit 2018 von der Deutschen Myastheniegesellschaft zertifizierten integrierten Myasthenie-Zentrums (iMZ) Freiburg.
Ist eine Nachsorge erforderlich?
Da alle Thymome als bösartig gelten, ist wie bei jedem anderen malignen Tumor eine Nachsorge zu empfehlen. Bei der Nachsorgebetreuung der Patienten sollte beachtet werden, dass Thymome eine hohe Lokalrezidivrate aufweisen und auch nach einer Operation neue Tumormanifestationen in bis zu 10 Jahren entstehen können. Dabei muss insbesondere auch auf das Auftreten von so genannten Folgetumoren (Zweitkarzinomen) (Non-Hodgkin Lymphom, Weichteilsarkom) geachtet werden, welche vermehrt bei Thymomen zu finden sind.
Im Rahmen der Nachsorge sollte eine regelmäßige Vorstellung des Patienten alle drei Monate in den ersten zwei Jahren mit Anamnese und körperlicher Untersuchung erfolgen. Darüber hinaus sollte alle 12 Monate ein CT-Thorax durchgeführt werden, da dadurch Lokalrezidive erkannt werden können. Diesbezüglich sollte die Nachsorge idealerweise bei dem erstbehandelnden Thoraxchirurgen erfolgen, eine Vorstellung des Patienten in regelmäßigen Abständen bei einem Neurologen sollte bei nachgewiesener Myasthenie erfolgen.
Klinik für Thoraxchirurgie
Hugstetter Straße 55
79106 Freiburg
Unsere Klinikbroschüre zum Herunterladen
Zertifikate