Helicobacter pylori
Das Institut hat eine lange Tradition in der Erforschung und Diagnostik der Helicobacter pylori - Infektion, ebenso bei der Empfehlung von Therapien bei dieser Infektion. Bereits vor über 25 Jahren hat sich Herr Professor Manfred Kist an unserem Institut als einer der ersten Mediziner in Deutschland mit diesem Keim befasst und bis zu seiner Emeritierung 2011 viel zu Erforschung und Therapie der Infektion beigetragen. Prof. Kist hat das Nationale Referenzzentrum Helicobacter an unserem Institut aufgebaut und bis zu seinem Ausscheiden geleitet. Das Institut führt auch heute diese Tradition mit dem Schwerpunkt der diagnostischen Beurteilung bei der Helicobacter pylori - Infektion fort.
PD Dr. med. Erik Oliver Glocker (Gastwissenschaftler)
Telefon: +49 761 270-83656
Telefax: +49 761 270-83703
erik-oliver.glocker@uniklinik-freiburg.de
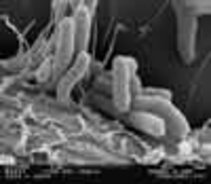
Anheftung von Helicobacter pylori an Magenzellen (17000 fach vergrössert)
Helicobacter pylori (= „helikales Stäbchen des Magenausgangs“) (H. pylori) ist ein anspruchsvolles Gram-negatives Bakterium, das nur auf speziellen Nährböden bei 5% Sauerstoff-Atmosphäre wächst. H. pylori wurde 1982 in Perth, Australien, zum ersten Mal aus einer Magen-Gewebsprobe einer Patientin mit Magenschleimhautentzündung (Gastritis) angezüchtet, letzteres nur deswegen, weil die Anzuchtplatten wegen der Osterfeiertage länger im Brutschrank standen als üblich und somit die langsam wachsenden Bakterien Gelegenheit hatten, sich ausreichend zu vermehren. Eine kontrollierte Studie zeigte dann bald, dass H. pylori als Ursache der Gastritis anzusehen ist, weitere Studien machten klar, dass auch das Magengeschwür und mehr noch das Zwölffingerdarmgeschwür durch H. pylori in ihrer Entstehung begünstigt werden und durch Antibiotika sowohl der Erreger beseitigt als auch die Geschwürskrankheit dauerhaft geheilt werden kann. Für die Entdeckung von H. pylori wurden Barry Marshal und Robin Warren im Jahr 2005 mit dem Nobelpreis für Medizin ausgezeichnet. Aus diesen Gründen wurden in der Folge mehr und mehr H. pylori - Infektionen antibiotisch behandelt, meist mit einer Kombination aus einem säurehemmenden Medikament und zwei Antibiotika. Die Häufigkeit der H. pylori - Eradikationsbehandlungen hat inzwischen eher noch zugenommen, seit sich Hinweise verdichtet haben, dass der Erreger auch die Entstehung eines Magenkarzinoms begünstigen kann. H. pylori wurde deshalb von der WHO als erstes karzinogenes Bakterium deklariert.
Da bisher im Gegensatz zu anderen chronischen Infektionen, wie z. B. bei der Tuberkulose, häufig keine Empfindlichkeitstestung vor der Therapie erfolgt, sondern mit fixen Antibiotikakombinationen behandelt wird, treten bei H. pylori zunehmend Resistenzen gegen die eingesetzten Antibiotika auf, die eine wirksame Behandlung bedeutend erschweren können.
Die Übertragung von H. pylori erfolgt am häufigsten im Kleinkindesalter und zwar von Mensch zu Mensch. Wie andere infektiöse Kinderkrankheiten wird die Ansteckung durch ungünstige hygienische Bedingungen, sowie durch häufige Durchfallkrankheiten und Fehlernährung außerordentlich gefördert. Lebensmittel als Infektionsquelle sind bis heute nicht identifiziert worden. Eine schlechte Trinkwasserqualität wirkt sich eher durch eine Zunahme der Durchfallattacken begünstigend auf die Mensch-zu-Mensch Übertragung aus, da Bakterien aus dem Magen bei Durchfall schneller den Darmtrakt durchwandern und infektionsfähig mit dem Stuhl ausgeschieden werden.
Die Infektionshäufigkeit ist deshalb in Entwicklungsländer extrem hoch, in Industrieländern ist sie seit Jahren eher rückläufig. Allerdings ist die Erkrankung immer noch so häufig, dass sie nach wie vor ein gesundheitspolitisches Problem darstellt.
Pathogenitätsfaktoren von Helicobacter pylori
Aufgrund der aggressiven Magensäure ist die Magenschleimhaut nur von Bakterien zu erreichen, die für diese unwirtliche Umgebung hochspezialisiert sind. H. pylori hat die Fähigkeit, im Magen zu überleben und eine chronische Infektion der Magenschleimhaut hervorzurufen. Dafür stehen ihm eine Vielzahl von „Werkzeugen“ zur Verfügung, die ihm die Spezialsierung ermöglichen und mit denen er seinen Wirt, den Menschen, krankmachen kann. Diese Werkzeuge werden als Pathogenitätsfaktoren bezeichnet und im Folgenden erklärt.
Flagellen:
H. pylori besitzt sogenannte Flagellen, die dem Keim eine hohe Beweglichkeit verleihen. Dadurch kann er sich auch im Magenschleim fortbewegen, die oberflächlichen Magenzellen erreichen und sich dort festsetzen.
Adhärenz:
Um sich an die Magenzellen anzuheften, bildet H. pylori sog. Adhäsine aus. Dabei handelt es sich um spezielle Strukturen, mit denen sich der Erreger an den Zellen wie mit einem Anker festhalten kann.
Urease:
Eine der charakteristischsten Eigenschaften von H. pylori ist die Bildung und Freisetzung von Urease, einem Enzym, das den im Magen vorkommenden Harnstoff in Kohlendioxid und Ammoniak umsetzen kann. Der entstandene Ammoniak kann die Magensäure neutralisieren und damit H. pylori schützen.
Vakuolisierendes Zytotoxin:
H. pylori gibt ein Zellgift ab, welches die Magenzellen zerstört. Da sich in den geschädigten Zellen bläschenartige Strukturen ausbilden, wurde das Zellgift Vakuolisierendes Zytotoxin oder VacA benannt.
Das VacA wird nach Kontakt zur Magensäure aktiv und entfaltet dann seine schädigende Wirkung auf die Magenzellen. Neben der Zellzerstörung beeinträchtigt VacA auch die Heilung und Regeneration der Magenschleimhaut.
Lipopolysaccharid (LPS):
Auf seiner Oberfläche trägt H. pylori Moleküle, die aus Fettsäuren und aus Zuckern bestehen. Diese Moleküle werden als Lipopolysaccharid der äußeren Membran (LPS) bezeichnet. Das LPS von H. pylori enthält Zuckerbausteine, welche dem Blutgruppensystem des Menschen ähneln. Dabei könnte es sich um eine Strategie des Keimes handeln, das menschliche Immunsystem zu täuschen und somit ein Langzeitüberleben im Magen zu ermöglichen
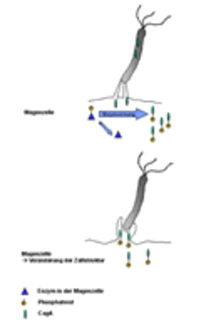
Injektion von CagA und Einbau von Phosphor durch ein Enzym der Magenzelle. Im Anschluß kommt es zu einer Veränderung der Zellstruktur (nach Stein et al., 1999).
cag-Pathogenitätsinsel:
Der wichtigste genetische Unterschied in Bezug auf die Gefährlichkeit der verschiedenen H. pylori-Stämme ist das Vorhandensein von cagPAI, Genen, welche für eine Art Pumpsystem codieren. Mit Hilfe dieser Pumpe, welche man sich wie eine Injektionsnadel vorstellen kann, wird CagA, ein Eiweißkörper von H. pylori, in die Magenzelle geschleust und dort von einem Enzym abgeändert, indem Phosphor an CagA gebunden wird. Im Anschluss kommt es zu einer Veränderung der Zellform: Es entstehen unter anderem Ausstülpungen der Zellmembran der Wirtszelle. Diese Veränderungen können zu ausgeprägten Schäden führen und möglicherweise zu einem erhöhten Risiko für die Ausbildung von Magenkrebs beitragen
H. pylori-assoziierte Erkrankungen
Aufgrund seiner Pathogenitätsfaktoren ist H. pylori in der Lage, die Magenschleimhaut zu besiedeln, was in der Regel eine Immunantwort und die typischen Zeichen einer Entzündungsreaktion hervoruft. Viele Patienten mit nachgewiesener H. pylori-Infektion zeigen jedoch, wenn überhaupt, nur eine dezente klinische Symptomatik.
Eine H. pylori-Infektion beginnt mit einer akuten Magenschleimhautentzündung (Gastritis). Nach einigen Wochen geht diese aktive Entzündung in eine chronische über. Diese chronische Infektion kann über lange Zeit fortbestehen und zu einer chronisch-atrophischen Gastritis führen, bei welcher die Schleim-, die Säure- und die Pepsin - produzierenden Zellen des Magens zugrundegehen.
In ca. 20% der Fälle kann es auf dem Boden einer Gastritis zur Ausbildung von Geschwüren kommen, welche außer dem Magen (Ulcus ventriculi) auch den Zwölffingerdarm (Ulcus duodeni) betreffen können. Sehr selten kann eine anhaltende H. pylori-Infektion nach Jahren zur Ausbildung eines Magencarcinoms (weniger als 1% der Fälle) oder eines sehr selten sogenannten MALT (mucosa-associated lymphoid tissue)-Lymphoms führen.
Nicht - invasive Diagnostik
Atemtest (Urea-Breath-Test)
Der Patient nimmt 13C- markiertem Harnstoff in einem zitronensäurehaltigen Getränk zu sich. H. pylori verfügt über ein Enzym, die sog. Urease, welche Harnstoff zu Ammoniak und Kohlendioxid umsetzt. Das Kohlendioxid enthält die 13C-markierten Kohlenstoffatome des eingenommenen Harnstoffs. Die 13C -Konzentration der Ausatmungsluft kann in einem Massenspektrometer gemessen werden. Dies erlaubt wiederum Rückschlüsse auf die Menge des umgesetzten Harnstoffs und somit auf die Hp-bedingte Ureaseaktivität im Magen. Die gleichzeitige Einnahme von säurehemmenden Medikamenten (Protonenpumpeninhibitoren) kann falsch negative Ergebnisse begünstigen. Vor der Durchführung des Tests sollte aus den gleichen Gründen auch auf den Konsum von Kaffee verzichtet werden.
Stuhluntersuchung
Der Patient gibt eine Stuhlprobe ab, in der mit einem speziellen Verfahren H. pylori-Bestandteile (Hp-Antigene) nachgewiesen werden können. Der Test kann neben der Diagnostik einer H. pylori-Infektion auch für die Überprüfung der Wirksamkeit einer antibiotischen Therapie (Eradikationstherapie) herangezogen werden. In einer Übersichtsarbeit (Metaanalyse von 25 Studien) von Gisbert und Pajares (2001) wurden die Sensitivität, die Spezifität, der negative Voraussagewert und der positive Vorausagewert des Verfahrens für Erstuntersuchungen mit 92%, 92%, 92% und 90% bestimmt. Wurden die Testverfahren zur Kontrolle nach Behandlung der Hp-Infektion eingesetzt, reduzierten sich die genannten Qualitätsmerkmale auf 88%, 92%, 75% und 94%.
Serologie (mit Blutentnahme)
Die Serologie ist eine sehr oft verwendete Technik zum Nachweis einer Infektion mit H. pylori. Dabei wird dem Patienten Blut entnommen (ca. 8-10 Milliliter), welches mit speziellen Testverfahren (ELISA und Immunblot) auf Antikörper gegen H. pylori untersucht wird. Die Untersuchung der Antikörperantwort auf H.pylori ist indiziert bei ausgeprägter Atrophie der Magenschleimhaut sowie bei Magenblutung und unter Therapie mit Protonenpumpeninhibitoren. Sind Antikörper nachweisbar, deutet dies auf einen Kontakt mit dem Erreger hin. Je nach der Konstellation des Befunds können Rückschlüsse auf eine aktuell bestehende oder eine durchgemachte Infektion gezogen werden. Da die Antikörper nach einer erfolgreichen antimikrobiellen Behandlung noch über Monate nachweisbar sind, eignet sich die serologische Untersuchung nicht zur unmittelbaren Kontrolle des Therapieerfolgs.
Invasive Diagnostik
Die zweifellos zuverlässigste Methode zum Nachweis einer Helicobacter-pylori-Infektion ist die Magenspiegelung (Gastroskopie) mit der Entnahme kleiner Gewebeproben (Biopsie) durch den Gastroenterologen. Sie erlaubt eine Sichtkontrolle des Magens und des Zwölffingerdarms; entzündliche Veränderungen (Gastritis), Geschwüre (Ulzera), Narben und bösartige Gewebeneubildungen sind so direkt sichtbar.
Vom Arzt während einer Gastroskopie entnommene Gewebeproben können (histopathologisch) auf Gewebsveränderungen untersucht werden, die eine Entzündung, eine Rückbildung (Atrophie) der Magenschleimhaut oder bösartige Veränderungen anzeigen. Weiterhin können Bakterien (u.a. H.pylori) mikroskopisch nachgewiesen werden. Der Gastroenterologe kann auch selbst mit einem Schnelltest (Helicobacter Urease Test=HUT) H. pylori direkt in der Biopsie nachweisen.
Im mikrobiologischen Labor wird H. pylori aus dem Magengewebe angezüchtet und seine Empfindlichkeit gegen die in der Behandlung gebräuchlichen Antibiotika bestimmt. Dies ermöglicht eine gezielte Therapie gegen den Erreger unter Einsatz sicher wirksamer Antibiotika. Der bakteriologisch-kulturelle Nachweis des Erregers gilt als „Goldstandard“, d. h. als die zuverlässigste, wenn auch nicht empfindlichste diagnostische Methode.
Kontrolle des Therapieerfolges
Nach Durchführung einer Eradikationstherapie sollte der Therapieerfolg kontrolliert werden mit:
- Atemtest oder Stuhltest
- Endoskopie und Probeentnahme (falls indiziert)
- Beratung zu Fragen der mikrobiologischen Diagnostik und Therapie für einsendende Ärzt*innen
- Anzucht von Helicobacter pylori aus klinischem Material und Empfindlichkeitstestung (Amoxicillin, Tetracylin, Levofloxacin, Clarithromycin, Metronidazol, Rifampicin)
- Durchführung von molekularen Verfahren zum Nachweis von H.pylori incl. resistenzvermittelnder Mutationen aus Magenbiopsien (Clarithromycin)
- Identifizierung anderer Helicobacter spp. durch PCR und Sequenzierung
- Initiierung von und Mitarbeit bei Surveillanceprojekten zur Bewertung der Resistenzentwicklung
Institut für Medizinische Mikrobiologie und Hygiene
Hermann-Herder-Str. 11
D-79104 Freiburg
Ärztlicher Direktor
Prof. Dr. Georg Häcker
E-mail: georg.haecker@uniklinik-freiburg.de
Direktionsassistentin
Kerstin Jost
Telefon: 0761 270 83631
Telefax: 0761 270 83703
E-mail: kerstin.jost@uniklinik-freiburg.de
Pforte
Jutta Schneeberger
Telefon: 0761 270 83700
Telefax: 0761 270 83703
Öffnungszeiten Pforte: Mo - Do 8:00 - 16:30 Uhr , Fr 8:00 - 15:30 Uhr
Bestellung von Transportmedien für H. pylori Resistenzbestimmungen
Telefon: 0761 270 83656
Telefax: 0761 270 83703
QMB
Sylvia Richards-Klatt
Telefon: 0761 270 83647
Telefax: 0761 270 83703
E-mail: sylvia.richards@uniklinik-freiburg.de
