Translationale Epilepsieforschung
Die Arbeitsgruppe beschäftigt sich mit den Grundlagen fokaler Epilepsien und der strukturellen und funktionellen Integration des epileptogenen Areals in das neuronale Netzwerk. Daraus entwickeln wir neue Ansätze zur individualisierten epilepsiechirurgischen Behandlung.
Es bestehen enge Kooperationen mit der Epilepsiechirurgie (Dr. Scheiwe, Dr. Shah) und dem Epilepsiezentrum (Prof. Dr. Schulze-Bonhage).


Latest news
Ein neues Paper zur Inhibition im Gyrus dentatus beim Down-Syndrom ist online! Diese Studie wurde durch Seed Money von Eucor finanziert und ist wirklich grenzübergreifend: Die Daten stammen aus Nicole's Masterarbeit in Basel und aus ihrer Doktorarbeit in Freiburg.
https://www.frontiersin.org/journals/cellular-neuroscience/articles/10.3389/fncel.2026.1714586/full

Dr. Julia M. Nakagawa wurde in das Berta-Ottenstein-Programm für Advanced Clinician Scientists (Förderperiode 2026-2028) aufgenommen. Herzlichen Glückwunsch, Julia!
https://uni-freiburg.de/med/forschung/qualifizierung-nach-der-promotion/bop/#ACS-Fellows
‘Alle Jahre wieder…’: Beim traditionellen AG TrEPI Weihnachtsmarkt-Event trafen sich aktuelle und ehemalige Mitarbeiter*innen.

AG Translationale Epilepsieforschung (Mai 2025)
Die grundlagenwissenschaftliche Untersuchung von verändertem epileptogenem Hirngewebe, wie beispielsweise bei fokaler corticaler Dysplasie oder Hippocampussklerose, in seiner neuronalen Komposition, Myelinisierung und Integration in das neuronale Netzwerk stellt einen Schwerpunkt der Arbeitsgruppe dar. Moderne zelluläre und molekulare Analysemethoden ermöglichen dabei die Erforschung der pathophysiologischen Hirngewebeveränderungen, ihres Ursprunges sowie ihrer Epileptogenizität.
Die Integration der epileptogenen Läsion in das strukturelle und funktionelle Netzwerk und die hieraus resultierende Veränderung ist Gegenstand translationaler Untersuchungen. In Kooperation mit der Medizinphysik und Klinik für Neuroradiologie werden durch MR-bildgebende Verfahren und innovatives Postprocessing strukturelle Veränderungen des Konnektoms erarbeitet und mit dem funktionellen epileptischen Netzwerk basierend auf der räumlichen Ausbreitung epileptischer Aktivität in Zusammenhang gebracht.
Epilepsiechirurgie mit Resektion des individuell definierten epileptogenen Areals, welches nach prächirurgischer epileptologischer Diagnostik ursächlich für die Epilepsie ist, ist eine sehr wirksame Therapieoption. Die Weiterentwicklung operativer Techniken zur exakten und sicheren operativen Behandlung ist dabei von besonderer Bedeutung. Ebenso Vordergrund steht, neben dem medizinischen Erfolg zur Behandlung der Epilepsie, die Zufriedenheit der betroffenen Patient*innen. Die gesundheitsbezogene Lebensqualität im Kontext der Erkrankung, gleichermaßen beeinflusst durch die chirurgische Therapie, wird daher wissenschaftlich bewertet und Therapiekonzepte auf diese Weise stetig verbessert.

PD Dr. Ute Häussler

Dr. Julia Nakagawa

Dr. Christian Scheiwe, Oberarzt
Leitung Epilepsiechirurgie

Nicole Gutmann, Doktorandin (PhD)

Lisa-Marie Baumann, Doktorandin (MD)

Quentin Henning, Doktorand (MD)

Niklas Knörr, Doktorand (MD)

Elias Kremer, Doktorand (MD)

Laurin Rienhardt, Doktorand (MD)

Hans Rumpf, Doktorand (MD)

Dziyana Saifi, Doktorandin (MD)

Friederike Schober, Doktorandin (MD)

Henrike Wilms, Doktorandin (MD)

Andrea Maletz, MTA

Fabian Preußger, Bachelorstudent
Dr. Piret Kleis (PhD/Wiss. Mitarbeiterin)
Dr. Catharina Donkels (PostDoc)
Johanna Binz, B.Sc. Biologie
Anabel Mersi, M.Sc. Biologie
Florian Raue, Doktorand (MD)
2026
Gutmann N, Häussler U, Mersi A, Follo M, Bischofberger J, Schulz JM (2026) Increased dendritic inhibition of dentate gyrus granule cells in a mouse model of Down syndrome. Frontiers in Cellular Neuroscience. doi:10.3389/fncel.2026.1714586 (access to article)
2025
Kleis P, Paschen E, Djie-Maletz A, Vlachos A, Haas CA*, Häussler U* (2025) Long-term hippocampal low-frequency stimulation alleviates focal seizures, memory deficits and synaptic pathology in epileptic mice. Neurobiology of Disease 212:106965. doi:10.1016/j.nbd.2025.106965 (access to article)
Kleis P, Paschen E, Djie-Maletz A, Vlachos A, Haas CA*, Häussler U* (2025) Long-term hippocampal low-frequency stimulation alleviates focal seizures, memory deficits and synaptic pathology in epileptic mice. bioRxiv. doi: 10.1101/2025.01.16.633322 (access to article)
Donkels C, Häussler U, Huber S, Tiesmeyer N, Demerath T, Scheiwe C, Shah MJ, Heers M, Urbach H, Schulze-Bonhage A, Prinz M, Vlachos A, Beck J, Nakagawa JM*, Haas CA* (2024) Dysregulation of Myelination in Focal Cortical Dysplasia Type II of the Human Frontal Lobe. Glia 73(5):928-947. doi:10.1002/glia.24662 (access to article)
2024
Donkels D, Huber S, Demerath T, Scheiwe C, Shah MJ, Heers M, Urbach H, Schulze-Bonhage A, Prinz M, Häussler U, Vlachos A, Beck J, Nakagawa JM*, Haas CA* (2024) Focal cortical dysplasia type II-dependent maladaptive myelination in the human frontal lobe. bioRxiv. doi: 10.1101/2024.03.02.582894 (access to article)
Kleis P, Paschen E, Häussler U*, Haas CA* (2024) Low frequency stimulation for seizure suppression: Identification of optimal targets in the entorhinal-hippocampal circuit. Brain Stimulation 17(2):395-404. doi: 10.1016/j.brs.2024.03.017 (access to article)
Kleis P, Paschen E, Häussler U, Haas CA (2024) Low frequency stimulation for seizure suppression: Identification of optimal targets in the entorhinal-hippocampal circuit. bioRxiv. doi: 10.1101/2024.02.09.579614 (access to article)
Paschen E, Kleis P, Vieira DM, Heining K, Böhler C, Egert U, Häussler U, Haas CA (2024) On-demand low-frequency stimulation for seizure control: efficacy and behavioral implications Brain 147(2):505-520. doi: 10.1093/brain/awad299 (access to article)
Häussler U, Neres J, Vandenplas C, Eykens C, Kadiu I, Schramm C, Fleurance R, Stanley P, Godard P, de Mot L, van Eyll J, Knobeloch KP, Haas CA, Dedeurwaerdere S (2024) Downregulation of ubiquitin-specific protease 15 (USP15) does not provide therapeutic benefit in experimental mesial temporal lobe epilepsy. Molecular Neurobiology 61:2367-2389. doi: 10.1007/s12035-023-03692-2 (access to article)
2023
Urbach H, Scheiwe C, Shah MJ, Nakagawa JM, Heers M, San Antonio-Arce MV, Altenmueller DM, Schulze-Bonhage A, Huppertz HJ, Demerath T, Doostkam S (2023) Diagnostic Accuracy of Epilepsy-dedicated MRI with Post-processing. Clin Neuroradiol 33(3):709-719, doi: 10.1007/s00062-023-01265-3. access to article
Franz J*, Barheier N*, Tulke S, Wilms H, Haas CA, Häussler U (2023) Differential vulnerability of neuronal subpopulations of the subiculum in a mouse model for mesial temporal lobe epilepsy. Front. Cell. Neurosci. 17:1142507. access to article
Kilias A, Tulke S, Barheier N, Ruther P, Häussler U (2023) Integration of the CA2 region in the hippocampal network during epileptogenesis. Hippocampus 33: 223-240. access to article
2022
Schwabenland M, Barvulsky EA, Nakagawa JM, Prinz M, Urbach H, Erny D, Taschner CA (2022) Freiburg Neuropathology Case Conference : A 58-year-old Patient with an Asymptomatic Cerebellopontine Angle Mass Lesion. Clin Neuroradiol 32(2):587-592. doi: 10.1007/s00062-022-01175-w. access to article
Kleis P, Paschen E, Häussler U, Bernal Sierra YA, Haas CA (2022) Long-term in vivo characterization and application of a novel potassium channel-based optogenetic silencer in the healthy and epileptic mouse hippocampus. BMC Biology 20:18. doi: 10.1186/s12915-021-01210-1. access to article
2021
Freiman TM*, Häussler U*, Zentner J, Dooskamp S, Beck J, Scheiwe C; Brandt A, Haas CA, Puhahn-Schmeiser B (2021) Hippocampal mossy fiber sprouting into CA2 in temporal lobe epilepsy. Hippocampus. doi: 10.1002/hipo.23323. access to article
2020
Donkels C, Peters M, Fariña Núñez MT, Nakagawa JM, Kirsch M, Vlachos A, Scheiwe C, Schulze-Bonhage A, Prinz M, Beck J, Haas CA (2020) Oligodendrocyte lineage and myelination are compromised in the gray matter of focal cortical dysplasia type IIa. Epilepsia 61(1):171-184. doi: 10.1111/epi.16415. access to article
Paschen E, Elgueta C, Heining K, Vieira D, Kleis P, Orcinha C, Häussler U, Bartos M, Egert U, Janz P, Haas CA (2020) Hippocampal low-frequency stimulation prevents seizure generation in a mouse model of mesial temporal lobe epilepsy. eLife 9:e54518. doi: 10.7554/eLife.54518. access to article
2019
Heining K, Kilias A, Janz P, Häussler U, Kumar A, Haas CA, Egert U (2019) Bursts with high and low load of epileptiform spikes show context-dependent correlations in epileptic mice. eNeuro 6:0299-18. access to article
Tulke S, Haas CA, Häussler U (2019) Expression of brain-derived neurotrophic factor and structural plasticity in the dentate gyrus and CA2 region correlate with epileptiform activity. Epilepsia 60:1234-1247. access to article
2018
Nakagawa JM, Trippel M, Doostkam S, Mader I, Coenen VA, Reinacher PC (2018) The stereotactic suboccipitaltranscerebellar approach to lesions of the brainstem and the cerebellum.Clin Neurol Neurosurg 166:10-15. doi: 10.1016/j.clineuro.2018.01.015. access to article
Kilias A, Häussler U, Heining K, Froriep UP, Haas CA, Egert U (2018) Theta frequency decreases throughout the hippocampal formation in a focal epilepsy model. Hippocampus 28: 375-391. DOI: 10.1002/hipo.22838. access to article
2017
Gremmelspacher T, Gerlach J, Hubbe A, Haas CA, Häussler U (2017) Neurogenic processes induced by very short periods of voluntary wheel-running in male mice. Front. Neurosci. 11:385. doi: 10.3389/fnins.2017.00385. access to article
Urbach H, Egger K, Rutkowski K, Nakagawa JM, Schmeiser B, Reisert M, Brandt A, Steinhoff BJ, Schulze-Bonhage A, Hammen T (2017) Bilateral cingulum fiber reductions in temporal lobe epilepsy with unilateral hippocampal sclerosis. Eur J Radiol 94:53-57. doi: 10.1016/j.ejrad.2017.07.015. access to article
Nakagawa JM, Donkels C, Fauser S, Schulze-Bonhage A, Prinz M, Zentner J, Haas CA (2017) Characterization of focal cortical dysplasia with balloon cells by layer-specific markers: Evidence for differential vulnerability of interneurons. Epilepsia 58(4):635-645. doi: 10.1111/epi.13690. access to article
Janz P*, Schwaderlapp N*, Heining K*, Häussler U, Korvink JG, von Elverfeldt D, Hennig J, Egert U, LeVan P*, Haas CA* (2017) Early tissue damage and microstructural reorganization predict disease severity in experimental epilepsy. *equal contribution. eLife 2017;6:e25742 doi: 10.7554/eLife.25742. access to article
Janz P, Savanthrapadian S, Häussler U, Kilias A, Nestel S, Kretz O, Kirsch M, Bartos M, Egert U, Haas CA (2017) Synaptic remodeling of entorhinal input contributes to an aberrant hippocampal network in temporal lobe epilepsy. Cerebral Cortex 27 (3): 2348-2364. access to article
Frühere Publikationen sind gelistet unter Pubmed:
Berta-Ottenstein Programm für Advanced Clinician Scientists (Dr. J. Nakagawa)
Otfrid-Förster-Stipendium der Deutschen Gesellschaft für Epileptologie (DGfE) (Dr. J. Nakagawa)
Stiftung Neurochirurgische Forschung der Deutschen Gesellschaft für Neurochirurgie (DGNC) (Dr. J. Nakagawa)
Deutsche Forschungsgemeinschaft (DFG) (PD Dr. Ute Häussler)
Wissenschaftliche Gesellschaft Universität Freiburg (PD Dr. Ute Häussler/Dr. Julia Nakagawa)
EUCOR – The European Campus, Seed Money (PD Dr. Ute Häussler)
Forschungskommission der Medizinischen Fakultät, Universität Freiburg (PD Dr. Ute Häussler, Dr. J. Nakagawa)
BrainLinks-BrainTools (PD Dr. Ute Häussler)
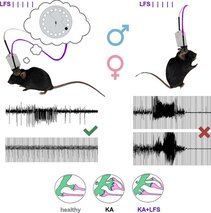




Neuestes Paper: Long-term hippocampal low-frequency stimulation alleviates focal seizures, memory deficits and synaptic pathology in epileptic mice.
Kleis P, Paschen E, Djie-Maletz Andrea, Vlachos A, Haas CA, Häussler U
Neurobiology of Disease (2025) https://doi.org/10.1016/j.nbd.2025.106965
- Piret Kleis hat am 30.04.2025 erfolgreich ihre Doktorarbeit mit dem Titel ‘Development of therapeutic strategies for seizure control in experimental epilepsy’ verteidigt. Herzlichen Glückwunsch, Piret!
- Konferenzmonat März: Dina und Hans haben bei der 13. Dreiländertagung Epileptologie in Salzburg Talks und Poster präsentiert, Piret hat ihr Poster beim 16th Göttingen Meeting of the German Neuroscience Society präsentiert.
- Anabel Mersi hat am 05.04.2024 die Ergebnisse ihrer Masterarbeit im präsentiert und damit den Studiengang M.Sc. Biologie erfolgreich abgeschlossen. Gratulation!
- Wir hosten zwei Symposien bei der Jahrestagung der Deutschen Gesellschaft für Epileptologie (DGfE) 2024: 'Stereo-EEG: A window into the brain to open personalized perspectives ' und 'Subtle cortical malformations: How can new technologies improve lesion detection?'
Klinik für Neurochirurgie
im Neurozentrum
Breisacher Straße 64
D-79106 Freiburg
Telefon: 0761 270-50010 /-50020
Telefax: 0761 270-50240
neurochirurgie@uniklinik-freiburg.de
Prof. Dr. Jürgen Beck
Ärztlicher Direktor
Telefon: 0761 270-50060
International call: +49-761-270-50060
j.beck@uniklinik-freiburg.de

André Doherr
Pflegedienstleiter
Telefon 0761 270-52260
Telefax 0761 270-54200
andre.doherr@uniklinik-freiburg.de

Christian Böke
Kaufmännische Geschäftsführung Neurozentrum
Telefon: +49 761 270-21071
christian.boeke@uniklinik-freiburg.de


