Angiogene Faktoren proliferativer Netzhauterkrankungen
Angiogenese-Labor
Hintergrund
Neben dem bekanntesten angiogenen Wachstumsfaktor VEGF spielen zahlreiche weitere pro- und anti-angiogene Faktoren eine wichtige Rolle bei der Entstehung und dem Fortschreiten angioproliferativer Netzhauterkrankungen. Hierzu zählen unter anderem Erythropoietin (Epo), Angiopoietin 1 und 2 (Ang1/2), der Insuline-like growth factor (IGF) oder auch pro- und anti-angiogen wirksame Lipidmediatoren (s. Projektseite Lipidmediatoren der Angiogenese). Einen wichtigen Beitrag zum Verständnis der jeweiligen Rolle dieser verschiedenen angiomodulativ wirksamen Faktoren in der Netzhaut leisten auf der einen Seite die verschiedenen Zellkultur- und Tiermodelle der retinalen bzw. chorioidalen Angiogenese. Auf der anderen Seite sind aber auch Untersuchungen an vom Menschen entnommenen Proben wesentlich, um eine Übertragbarkeit der grundlagenwissenschaftlichen Erkenntnisse auf den Menschen zu überprüfen.
Eigene Ergebnisse
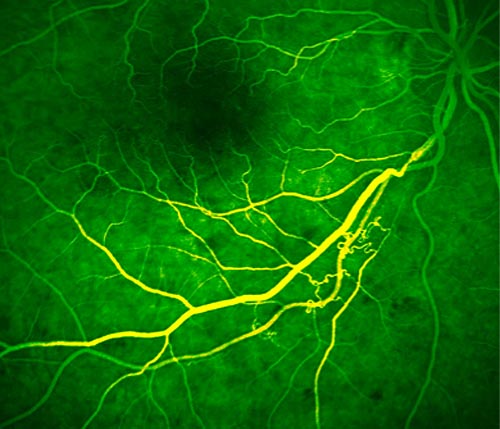
VEGF ist seit langem als wesentlicher Faktor bei der Entstehung pathologischer Blutgefäßneubildungen in der Netzhaut bekannt. Im Jahre 2005 wurden erstmals anti-VEGF Antikörper zur Behandlung der chorioidalen Neovaskularisation (CNV) bei der altersabhängigen Makuladegeneration eingesetzt. Bereits kurz danach zeigte sich, dass VEGF-Inhibitoren auch bei anderen gefäßassoziierten Netzhauterkrankungen eine therapeutische Rolle spielen können. Beispielsweise kommt es nach retinalen Venenverschlüssen (Abb. 1) häufig zu einer zumindest teilweise VEGF-vermittelten Hyperpermeabilität retinaler Kapillaren mit der Ausbildung eines meist deutlich visusmindernden Makulaödems [1]. Die intravitreale Injektion von anti-VEGF Antikörpern kann diese Hyperpermeabilität retinaler Gefäße vermindern und die normale Architektur der Makula in vielen Fällen zumindest zeitweise wiederherstellen (Abb. 2) [2]. Bei längerer Nachbeobachtung zeigt sich allerdings, dass nicht bei allen Patienten eine bleibende Visusbesserung erreicht werden kann. Wichtige Einflussfaktoren auf die langfristige Wirksamkeit einer anti-VEGF Behandlung nach retinalem Venenverschluss scheinen unter anderem der Ausgangsvisus sowie das Ansprechverhalten auf die erste Injektion zu sein [3]. Wichtig zu betonen ist, dass nach derzeitigem Wissensstand, auch die wiederholte Inhibition von VEGF keine schweren negativen Auswirkungen auf die Funktionalität der humanen Netzhaut zu haben scheint [4].
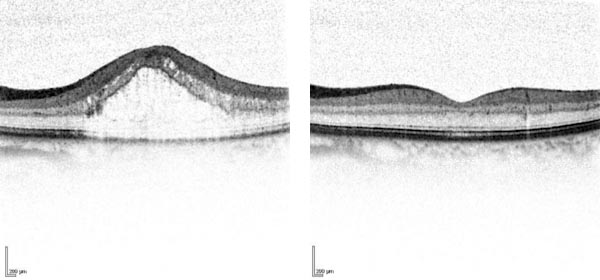
Abb. 2: Therapie des Makulaödems mit intravitrealer Injektion von VEGF-Inhibitoren. Das durch die erhöhte Gefäßpermeabilität entstandene Makulaödem (linkes Bild) kann durch intravitreale Injektion von anti-VEGF-Medikamenten vollständig resorbiert werden (rechtes Bild). Allerdings sind meist mehrere Injektionen notwendig und nicht bei allen Patienten zeigt sich ein Ansprechen auf die Therapie.
Der Grund, warum nicht alle Patienten gleich gut auf eine anti-VEGF-Therapie ansprechen, könnte unter anderem daran liegen, dass neben VEGF noch weitere Faktoren auf die pathologische Gefäßproliferation bzw. –permeabilität einwirken. Der Einfluß dieser Ko-Faktoren kann zwischen verschiedenen Patienten durchaus individuell unterschiedlich stark ausgeprägt sein. So zeigte sich beispielsweise bei der Analyse von retinalen Pigmentepithelzellen (RPE), welche aus chirurgisch entfernten CNV-Membranen von Patienten mit exsudativer AMD isoliert worden waren [5], dass RPE-Zellen unterschiedlicher Patienten unterschiedliche Kombinationen angiogener Wachstumsfaktoren exprimieren und unterschiedlich gut auf eine VEGF-Inihibition ansprechen [6]. Bei einigen RPE-Isolaten kann durch die Hemmung anderer angiogener Signalwege eine Reduktion der angiogenen Aktivität der RPE-Zellen erreicht werden [7]. Zur großen Gruppe der potentiell angiogen wirksamen Ko-Faktoren gehört unter anderem Erythropoietin (Epo), welches ähnlich wie VEGF deutlich erhöht im Glaskörper von Patienten mit retinalem Venenverschluss gefunden wird [8]. Allerdings ist für Epo noch nicht letztlich nachgewiesen, ob es durch seine pro-angiogenen Eigenschaften eher negative Effekte auf die Entwicklung pathologischer Proliferationsareale ausübt, oder ob es durch seine neuroprotektiven und möglicherweise auch anti-ödematösen Eigenschaften nicht möglicherweise auch eine protektive Rolle in der geschädigten Netzhaut spielt. Die derzeit laufenden Projekte haben daher zum Ziel, die Rolle verschiedener angiogen und anti-angiogen wirksamer Faktoren auf angioproliferative Netzhauterkrankungen weiter aufzuschlüsseln und ihre Übertragbarkeit auf den Menschen zu untersuchen.
Projektbezogene Literatur
[1] Feltgen N., Pielen A., Hansen L.L., Bertram B., Agostini H., Jaissle G., Hoerauf H., Stahl, A.
‘Intravitreale Medikamenteneingabe bei retinalem Venenverschluss – Pathophysiologische Mechanismen und angewandte Substanzen‘ (invited Review Article)
Klin. Monatsbl. Augenheilkunde 2010 Sep;227(9):681-93
[2] Stahl A., Agostini H.T., Hansen L.L., Feltgen N.
‘Bevacizumab in retinal vein occlusion – results of a prospective case series’
Graefes Arch Clin Exp Ophthalmol. 2007 Oct;245(10):1429-36
[3] Stahl A., Struebin I., Hansen L.L., Agostini H.T., Feltgen N.
‘Bevacizumab in central retinal vein occlusion - a retrospective analysis after two years of treatment’ Eur J Ophthalmol. 2010 Jan-Feb;20(1):180-5
[4] Stahl A., Feltgen N., Fuchs A., Bach M.
‘Electrophysiological evaluation of retinal photoreceptor function after repeated bevacizumab injections’
Doc Ophthalmol. 2009 Apr;118(2):81-8
[5] Schlunck G., Martin G., Agostini H.T., Camatta G., Hansen L.L.
‘Cultivation of retinal pigment epithelial cells from human choroidal neovascular membranes in age related macular degeneration.’
Exp Eye Res. 2002 May;74(5):571-6.
[6] Stahl A., Paschek L., Martin G., Feltgen N., Hansen L.L., Agostini H.T.
‘Combinatory inhibition of VEGF and FGF2 is superior to solitary VEGF inhibition in an in vitro model of RPE-induced angiogenesis’
Graefes Arch Clin Exp Ophthalmol. 2009 Jun;247(6):767-73
[7] Stahl A., Paschek L., Martin G., Feltgen N., Hansen L.L., Agostini H.T.
‘Rapamycin reduces VEGF expression in retinal pigment epitehlium (RPE) and inhibits RPE-induced sprouting angiogenesis in vitro’
FEBS Lett. 2008 Sep 3;582(20):3097-102
[8] Stahl A.,Buchwald A., Martin, G., Junker, B., Chen, J., Hansen, L.L., Agostini, H.T.,
Smith, L.E.H., Feltgen, N. ‘Vitreal levels of erythropoietin are increased in patients with retinal vein occlusion and correlate with vitreal VEGF and the extent of macular edema’
Retina. 2010 Oct;30(9):1524-9.