Neuronale Leitmoleküle als angiogene Regulatoren
Angiogenese-Labor
blood June 2011 [2]
Hintergrund
Neuronale Leitmoleküle (guidance cues), welche ursprünglich im Rahmen axonaler Zielfindung identifiziert worden waren, sind in den letzten Jahren zunehmend auch mit der Regulation angiogener Vorgänge in Verbindung gebracht worden. Die Gruppe angiogen wirksamer neuronaler Leitmoleküle umfasst unter anderem die Familien der Semaphorine und Ephrine sowie das Robo/Slit und das Netrin/DCC/UNC5-System. Die Rolle dieser neuronalen guidance cues bei angioproliferativen Netzhauterkrankungen ist jedoch noch kaum erforscht. Ziel dieses Projekts ist es, die Rolle neuronaler Leitmoleküle, insbesondere der Semaphorine, bei der pathologischen Angiogenese am Augenhintergrund zu untersuchen und neue Ansatzpunkte für die Behandlung visusbedrohender, angioproliferativer Erkrankungen zu finden. Dieses Projekt wird in Kollaboration mit Prof. Mike Klagsbrun und Prof. Lois Smith in Boston sowie Prof. Przemyslaw Sapieha in Montreal bearbeitet.
Eigene Ergebnisse
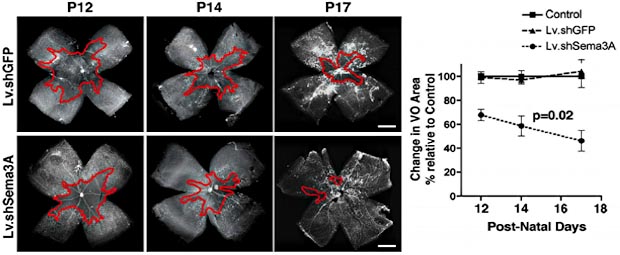
Erste Arbeiten befassten sich mit der Regulation der beiden Semaphorin-Rezeptoren Neuropilin 1 und 2. Die daraus entstandene Arbeit identifizierte NRSE (neuron restrictive silencer element) als transkriptionellen Repressor der Genaktivität von Neuropilin 1 (NRP1) [1]. Durch Überexpression des NRSE-Liganden NRSF (neuron restrictive silencer factor) konnte experimentell die NRP1-Expression sowohl auf Gen- als auch Proteinebene vermindert werden. Umgekehrt führte eine dominant negative NRSF-Expression zu einem Anstieg von NRP1. Funktionell führte eine NRSF-vermittelte Verminderung der NRP1-Expression zu einer Verminderung des Sema3A-Effekts auf die Zellmigration von Keratinozyten. Die aktuellen Arbeiten konzentrieren sich auf die Rolle der Semaphorine in der Netzhaut. Erste Ergebnisse fanden, dass mit Semaphorin 3A (Sema3A) eines der löslichen Semaphorine selektiv in hypoxischen Ganglienzellen der innersten Netzhautschichten exprimiert wird [2]. Durch seine angiorepulsive Wirkung verhindert Sema3A in diesen innersten Retinaschichten das Einsprossen funktioneller Blutgefäße in die hypoxischen Netzhautareale. Durch shRNA-vermittelten knockdown von Sema3A kann diese anti-angiogene Barriere aufgehoben werden und eine effektive Revaskularisierung der hypoxischen Netzhaut wird ermöglicht (Abb. 1). Dadurch werden avaskuläre Areale der Netzhaut wieder mit Blutgefäßen versorgt und die hypoxievermittelte Ausbildung präretinaler Proliferationsareale wird vermindert (Abb. 2).
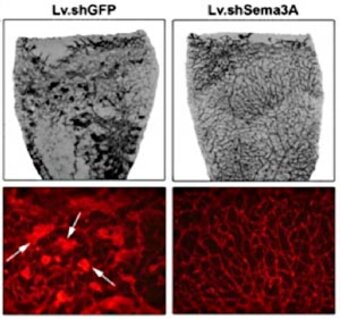
Abb. 2: Die beschleunigte Revaskularisierung avaskulärer Netzhautareale in Gruppen mit knockdown von Sema3A (Lv.shSema3A) bedingt eine verminderte hypoxiebedingte VEGF-Ausschüttung und es kommt zu einer deutlich verminderten Ausbildung präretinaler Proliferationen.
In dem gezeigten Modellsystem greift eine Sema3A-Modulation deutlich früher als die bekannten VEGF-Inhibitoren in die Entstehung einer proliferativen Retinopathie ein, indem durch die bessere Revaskularisierung avaskulärer Netzhautareale die retinale Gewebshypoxie vermindert wird, bevor es überhaupt zu einer übermäßigen VEGF-Ausschüttung kommt. Dieses kürzlich veröffentlichte Konzept war auch Gegenstand eines Editorial Comments in derselben Ausgabe von Blood [3]. Interessant ist die Frage, inwieweit sich dieses Konzept auf menschliche Krankheitsbilder wie beispielsweise die proliferative diabetische Retinopathie übertragen lässt, bei der es ähnlich wie im gezeigten Modellsystem zunächst zur Entstehung avaskulärer Areale und – wenn diese nicht revaskularisiert bzw. mit Laserkoagulation behandelt werden – zur Ausbildung sekundärer präretinaler Proliferationsareale kommt. Neben dieser Frage ist ein weiterer Schwerpunkt der gegenwärtigen Untersuchungen, die Übertragbarkeit des gezeigten Mechanismus auf andere Krankheisbilder in der Netzhaut. Beispielsweise könnten Semaphorine auch bei der altersabhängigen Makuladegeneration (AMD) eine wichtige pathomechanistische Rolle spielen. Darüber hinaus ist die Rolle neuronaler Leitmoleküle auf vaskuläre Krankheitsbilder ausserhalb der Netzhaut, beispielsweise bei Tumorleiden oder kardiologischen Erkrankungen, Gegenstand weiterer Studien (Abb. 3).
Projektbezogene Literatur
[1] Kurschat P., Bielenberg D., Rossignol-Tallandier M., Stahl A., Klagsbrun M.
‘Neuron restrictive silencer factor NRSF/REST is a transcriptional repressor of neuropilin-1 and diminishes the ability of semaphorin 3A to inhibit keratinocyte migration’
Journal of Biological Chemistry (JBC) 2006 Feb 3;281(5):2721-9
[2] Joyal JS., Sitaras N., Binet F., Rivera JC., Stahl A., Zaniolo K., Shao Z., Polosa A., Zhu T., Hamel D., Djavari M., Kunik D., Honoré JC., Picard E., Zabeida A., Blais M., Varma DR., Hickson G., Mancini J., Klagsbrun M., Costantino S., Beauséjour C., Lachapelle P., Smith LEH., Chemtob S., Sapieha P.
‘Ischemic neurons repel vessels by secreting Semaphorin 3A in proliferative retinopathies’
Blood (cover article) 2011 Jun 2;117(22):6024-35.
[3] Duh EJ. ‘Sema 3A resists retinal revascularization.’
Blood. 2011 Jun 2;117(22):5785-6.
[4] Stahl A., Smith L.E.H.
‘An eye for discovery’ (invited Review series introduction)
Journal of Clinical Investigation (JCI) 2010 Sep 1;120(9):3008-11