Sphäroidmodell der RPE-induzierten Angiogenese
Angiogenese-Labor
American Journal of Pathology [1]
Hintergrund
Die Altersabhängige Makuladegeneration (AMD) stellt eine der Hauptursachen für signifikante Sehminderung und Erblindung in Industrienationen dar. In den USA beispielsweise betrifft sie bereits über 10 Millionen Menschen und auch in Deutschland wird die Zahl der AMD-Patienten mit der zunehmenden Lebenserwartung der Bevölkerung weiter ansteigen. Die exsudative (oder feuchte) Spätform der AMD, bei der es zur pathologischen Aktivierung chorioidaler Angiogenese kommt, ist dabei häufig die aggressivste Verlaufsform. Es herrscht bisher jedoch weitgehend Unklarheit darüber, welche genauen Mechanismen einer Aktivierung der angiogenen Kaskade und damit einer Konversion von trockener zu feuchter AMD vorangehen. Vermutet wird eine Sequenz von Ereignissen: Alterungsprozesse und Schädigung von retinalen Pigmentepithelzellen (RPE) einerseits sowie chronische Entzündungsvorgänge im Bereich von Bruch-Membran und chorioidalen Kapillaren andererseits führen zu einer Störung des lokalen Gleichgewichts pro- und anti-angiogener Faktoren in der äußeren Netzhaut. Kommt es zu einem Überwiegen der pro-angiogenen Mediatoren entsteht eine chorioidale Neovaskularisationsmembran (CNV), welche unbehandelt zu einem rasch fortschreitenden Verlust der zentralen Sehfähigkeit führen kann.
Eigene Ergebnisse
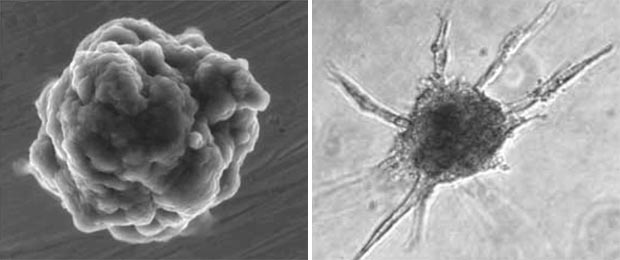
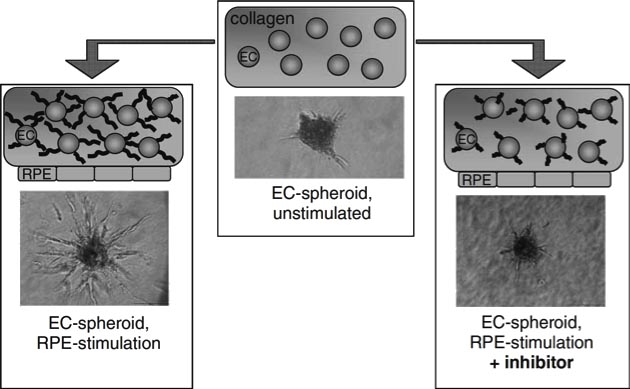
Um die Interaktion zwischen den beiden an der Pathogenese der feuchten AMD direkt beteiligten Zellpopulationen – Endothelzellen und RPE – direkt zu untersuchen, wurde auf ein dreidimensionales in vitro Angiogenesemodell zurückgegriffen, welches ursprünglich für endotheliale Monokulturen entwickelt worden war [2]. In diesem Modell werden Endothelzellen zu multizellulären Sphäroiden kultiviert (Abb. 1) und in eine Kollagenmatrix eingebracht. Durch Zugabe angiogen wirksamer Faktoren kommt es zu einer Aktivierung der ruhenden Endothelzellverbände und die Sphäroide bilden lumenhaltige, kapillarähnliche Aussprossungen (Abb. 2).
Abb. 1 (links): Rasterelektronenmikroskopische Aufnahme eines Endothelzellsphäroids. Durch Kultivierung von Endothelzellen im hängenden Tropfen in methozelhaltigem Medium entstehen Sphäroide bestehend aus jeweils ca. 500 Zellen (Abb. aus [3]).
Abb. 2 (rechts): Sprossender Endothelzellsphäroid in Kollagenmatrix. In dreidimensionaler Kultur sprossen die Endothelzellen ausgehend von dem sphäroidalen Zellverband aus und bilden lumenhaltige kapillarähnliche Strukturen (Abb. aus [3]).
Das Sphäroidmodell kann genutzt werden, um beispielsweise Genexpressionsänderungen während der angiogenen Aktivierung zu untersuchen [4], oder die Interaktion von sprossenden Endothelzellen mit anderen Zelltypen zu analysieren [5]. Um spezifisch die Interaktion von RPE und Endothelzellen zu untersuchen, können Endothelzellsphäroide mit einem Monolayer aus RPE-Zellen kokultiviert werden. Diese Anordnung spiegelt zu einem gewissen Grad die in vivo Situation wider, bei der chorioidale Endothelzellen getrennt durch eine kollagenhaltige Extrazellulärmatrix in enger räumlicher Nähe zu einem Monolayer aus RPE-Zellen liegen (Abb. 3).
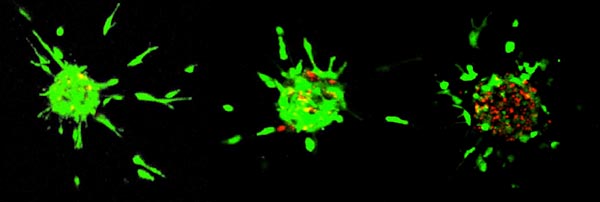
Neben der Analyse angiogener oder anti-angiogener Effekte in der Kokultur lassen sich auch wichtige Merkmale wie beispielsweise die Induktion von endothelialer Apoptose im Kokulturmodell untersuchen (Abb. 4). Durch die Verwendung unterschiedlicher RPE-Populationen können ausserdem Fragen nach interindividuellen Unterschieden im angiogenen Profil dieser Zellen beantwortet werden [7].
Abb. 4: Life/Death Färbung von Endothelzellsphäroiden in Kollagenmatrix. Die Zugabe verschiedener Inhibitoren hat unterschiedliche Auswirkungen auf den Endothelzellsphäroid. Links ist ein unbehandelter angiogen stimulierter Sphäroid dargestellt, nahezu alle Zellen sind vital (grün gefärbt). Zugabe von Rapamycin (mittleres Bild) hemmt die endotheliale Sprossung, erhöht aber die Zahl der apoptotischen (rot gefärbten) Endothelzellen kaum. Dagegen führt eine unselektive Hemmung des PI3K-Signalwegs zwar zu einer starken Reduktion der Angiogenese, aber auch zu einem Absterben der Endothelzellen und zur Auflösung des endothelialen Zellverbands (rechtes Bild). Abb. aus [7].
Projektbezogene Literatur
[1] Stahl A., Chen J., Sapieha P., Seaward M.R., Krah N.M., Dennison R.J., Favazza, T.,
Bucher F., Löfqvist C., Ong, H., Hellström A., Chemtob, S., Akula, J.D., Smith L.E.H.
‘Postnatal weight gain modifies severity and functional outcome of oxygen-induced proliferative retinopathy’
American Journal of Pathology (cover article) 2010 Dec;177(6):2715-23
[2] Korff T., Augustin H.G.
Tensional forces in fibrillar extracellular matrices control directional capillary sprouting.
J Cell Sci. 1999 Oct;112 ( Pt 19):3249-58.
[3] Wenger A., Stahl A., Weber H., Finkenzeller G., Augustin H.G., Stark G.B., Kneser U.
Modulation of in vitro angiogenesis in a three-dimensional spheroidal coculture model for bone tissue engineering,
Tissue Engineering 10 (2004), 1536-1547
[4] Stahl A., Wenger A., Weber H., Stark G.B., Augustin H.G., Finkenzeller G. Bi-directional cell contact-dependent regulation of gene expression between endothelial cells and osteoblasts in a three-dimensional spheroidal co-culture model,
Biochem Bioph Res Comm (BBRC) 322 (2004) 684-69
[5] Stahl A., Wu X., Wenger A., Klagsbrun M., Kurschat P. Endothelial progenitor cell sprouting in spheroid cultures is resistant to inhibition by osteoblasts: A model for bone replacement grafts.
FEBS Lett. 579 (2005) 5338–5342
[6] Stahl A., Paschek L., Martin G., Feltgen N., Hansen L.L., Agostini H.T.
Combinatory inhibition of VEGF and FGF2 is superior to solitary VEGF inhibition in an in vitro model of RPE-induced angiogenesis
Graefes Arch Clin Exp Ophthalmol. 2009 Jun;247(6):767-73
[7] Stahl A., Paschek L., Martin G., Feltgen N., Hansen L.L., Agostini H.T.
Rapamycin reduces VEGF expression in retinal pigment epitehlium (RPE) and inhibits RPE-induced sprouting angiogenesis in vitro
FEBS Lett. 2008 Sep 3;582(20):3097-102