Optogenetik
Die Optogenetik-Sektion entwickelt genetisch-kodierte, licht-aktivierbare Proteine zur Untersuchung und Steuerung biophysikalischer Prozesse im Herzen, von der Erregungsentstehung in einzelnen Zellen, über Signalweiterleitung im Zellverband, bis zur mechano-elektrischen Aktivität des ganzen Organs.
Licht-aktivierte Ionenströme
In der Optogenetik werden mikrobielle Rhodopsine, unter ihnen licht-aktivierbare Ionenkanäle (Kanalrhodopsine/ChRs) und fotoaktivierte Pumpen (Arch, Halorhodopsine), zur Veränderung der elektrischen Aktivität erregbarer Zellen verwendet. Dabei werden die Fotorezeptorproteine mittels genetischer Methoden unter Verwendung von Zelltyp-spezifischen Promotoren oder viraler Transduktion mit gewebsspezifischen Virusserotypen in die Zielzellen eingebracht. Gegenwärtig optimieren wir optogenetische Aktuatoren, welche ursprünglich für Anwendungen in der Neurophysiologie entwickelt wurden, für die gezielte Nutzung in Zellen des kardiovaskulären Systems und stellen Varianten her, die gezielt im Sarcolemma oder in subzellulären Kompartimenten angereichert sind (Abb. 1).
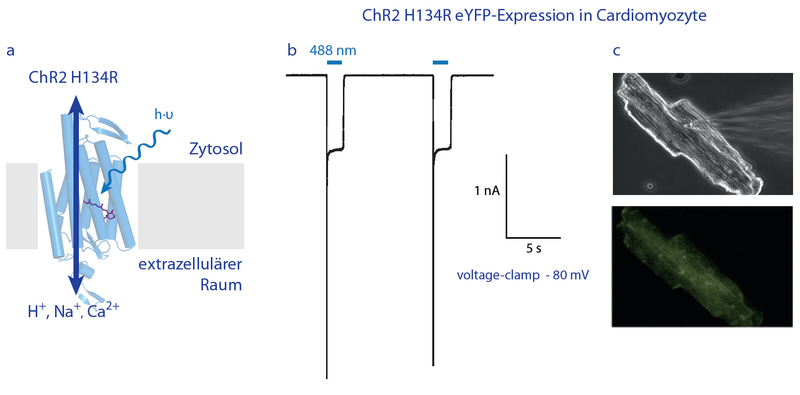
Kanalrhodopsin-2 (ChR2) ruft einwärts gerichtete (depolarisierende) Fotoströme in frisch isolierten Kardiomyozyten hervor. a) Strukturmodell des ChR2-Monomers basierend auf der C1C2-Struktur (Kato et al., 2012, pdb 3UG9). Das Retinalchromophor ist in violett eingezeichnet. b) Patch-Clamp-Messung einer ChR2-exprimierenden Herzmuskelzelle, bei der blaues Licht große Einwärtströme auslöst. c) Bilder einer isolierten Herzzelle mit Patch-Pipette; oben: Phasenkontrastaufnahme; unten: Fluoreszenz des mit ChR2 assozierten gelb-fluoreszierenden Proteins (eYFP).
Optogenetische Sensoren
Neben licht-aktivierbaren Aktuatoren gehören fluoreszierende Sensorsysteme, welche die direkte Visualisierung zellulärer Parameter wie Membranspannung, pH-Wert und zytosolischer Ca2+ Konzentration ermöglichen, zur optogenetischen Werkzeugkiste. Wir benutzen das spannungssensitive fluoreszierende Protein (VSFP 2.3), einen FRET-basierten Membranpotentialsensor, um die elektrische Aktivität von Herzmuskelzellen sowie von Zellen des Bindegewebes differenziert zu untersuchen (Abb. 2).
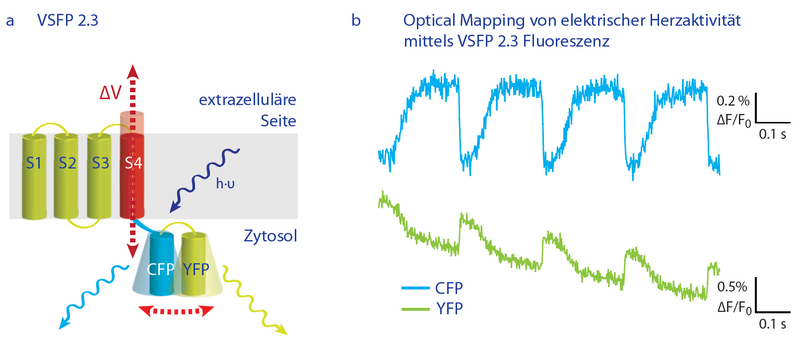
Spannungssensitive fluoreszierende Proteine erlauben uns, die elektrische Aktivität spezifischer Zellpopulationen zu verfolgen. a) Schematische Darstellung des molekularen Aufbaus sowie des Funktionsprinzips von VSFP 2.3. Änderungen der Membranspannung induzieren eine Verschiebung der vierten Transmembranhelix (S4), diese Konformationsänderung überträgt sich auf ein assoziiertes Paar Proteine, das aus dem cyan-fluoreszierenden CFP und dem gelb-fluoreszierenden YFP besteht. Die Effizienz des Förster-Resonanz-Energietransfers (FRET) zwischen Donor (CFP) und Akzeptor (YFP) verändert sich je nach Membranspannung, was wiederum mit messbaren Intensitätsveränderungen der beiden Fluorochrome verbunden ist. b) Beispielmessungen eines Optical Mapping-Experiments, in dem die elektrische Aktivität des linken Ventrikels (adulte Maus) untersucht wurde.
- Simon-Chica A, Fernández MC, Wülfers EM, Lother A, Hilgendorf I, Seemann G, Ravens U, Kohl P, Schneider-Warme F. Novel insights into the electrophysiology of murine cardiac macrophages: relevance of voltage-gated potassium channels. Cardiovasc Res 2022/118(3):798-813
- Zgierski-Johnston CM, Schneider-Warme F. Observing and manipulating cell-specific cardiac function with light. Adv Exp Med Biol 2021/1293:377-388
- Kopton RA [...] Moss R, Zgierski-Johnston CM [...] Kohl P, Quinn TA, Schneider-Warme F. Cardiac Electrophysiological Effects of Light-Activated Chloride Channels. Front Physiol 2018/9:1806
- Bernal Sierra YA*, Rost BR*, Pofahl M* [...] Kopton RA [...] Kohl P, Baier H, Schneider-Warme F [...] Schmitz D. Potassium channel-based optogenetic silencing. Nat Commun 2018/9:4611 (*equal contribution)
- Quinn AT, Camelliti P, Rog-Zielinska EA, Siedlecka U, Poggioli T, O'Tooled ET, Knöpfel T, Kohl P. Electrotonic coupling of excitable and nonexcitable cells in the heart revealed by optogenetics. PNAS 2016/doi: 10.1073/pnas.1611184114
- Schneider F, Grimm C and Hegemann P. Biophysics of channelrhodopsin. Annu Rev Biophys. 2015/44:167-86
- Optogenetics - Method of the Year 2010 Nature Methods 2011/8
Team

Dr. Franziska Schneider-Warme
Arbeitsgruppenleiterin

Leonardo Sacconi, PhD
Senior Scientist

Jan Rebers
E-Mail: jan.rebers@uniklinik-freiburg.de

Roberta De Zio, PhD
Guest Scientist

Ana Simón Chica, PhD
Guest Scientist