4D Bildgebung / Kardiale NanoDynamiken
In der Sektion 4D Bildgebung beschäftigen wir uns mit der kardialen Ultrastruktur im Nano- bis Mikromaßstab. Mit experimentellen Ansätzen versuchen wir aufzuklären, wie die Mechanik (sowohl die aktive Mechanik wie Zelldeformation, als auch die passive Mechanik wie Veränderungen der Steifigkeit und Belastbarkeit) die Elektrophysiologie und kontraktile Aktivität des Herzens beeinflusst und umgekehrt. Wir sind auch an der Art und Weise, wie die vielen verschiedenen Zelltypen im Herzen miteinander kommunizieren, interessiert.
Hauptforschungsgebiete sind:
1. Verformung der Organellen während des Herzzyklus - Struktur und funktionelle Konsequenzen
Das Herz ist ein mechanisch-aktives und -reagierendes Organ, das seine passiven und aktiven mechanischen Eigenschaften als Reaktion auf veränderte Anforderungen (z.B. bei körperlicher Anstrengung, Schwangerschaft, frühe "adaptive" Stadien der Herzinsuffizienz) sowohl bei jedem Herzschlag als auch durch lang anhaltende Remodellierung kontinuierlich anpasst.
Einer unserer Forschungsschwerpunkte beschäftigt sich mit der Frage, wie sich intrazelluläre Strukturen innerhalb von Herzmuskelzellen verformen und wie diese Verformung die Funktion des Herzens beeinflusst. Wir untersuchen speziell die Transversal(T)-Tubuli (TT), das sarkoplasmatische Retikulum, Caveolae, Mitochondrien und das Zytoskelett. Wir analysieren die Struktur (mittels hochmodernen bildgebenden Methoden: Konfokal-, Multiphotonen- und Elektronenmikroskopie) und die Funktion (Kontraktilität, Ionendiffusion) sowohl von Einzelzellen als auch von multizellulären Präparaten, die mechanischen Manipulationen, wie elektrischer Stimulation und Dehnung, ausgesetzt sind.
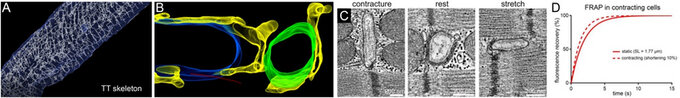
A: 3D TT-Netzwerk in einer ventrikulären Herzmuskelzelle, Rekonstruktion basierend auf konfokaler Mikroskopie. B: Elektronentomographische Rekonstruktion, TT (grün), sarkoplasmatisches Retikulum (gelb), Mitochondrien (blau), Mikrotubuli (rot). C: TT werden bei Dehnung und Kontraktion deformiert (gequetscht), was zu einer schnelleren Durchmischung des TT-Gehalts führt (D).
2. Interaktionen zwischen Muskelzellen und Nicht-Muskelzellen im Herzen
Viele Narben - wie z.B. in der Haut - sind a-zellulär und bestehen überwiegend aus fibrillärem Kollagen. Im Herzen hingegen ist fibrotisches Gewebe sehr "lebendig", wobei das allgegenwärtige Netzwerk der extrazellulären Matrix (ECM) ein Gerüst für die strukturelle und mechanische Integration der darin eingebetteten Zellen bietet. Wir arbeiten an der Identifikation neuartiger Faktoren, die die bidirektionale Interaktion zwischen verschiedenen Zelltypen beeinflussen können. Dazu verwenden wir eine Kombination aus Lebendzell-Manipulationen (genetisch, umweltbedingt, pharmakologisch), Bildgebung und biochemischen Methoden. Zur Untersuchung von humanen Herzerkrankungen wie Herzinsuffizienz und angeborenen Herzfehlern wird uns Human-Material durch die kardiovaskuläre Biobank (CVBB) zur Verfügung gestellt
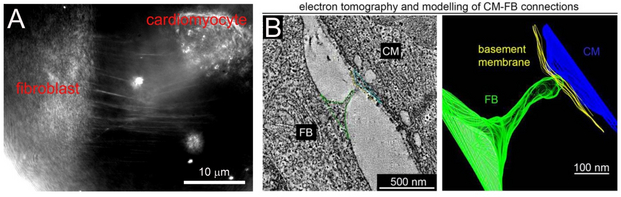
A: Membranausstülpungen zwischen einer Herzmuskelzelle und einem Fibroblasten, in vitro mittels rotierender kohärenter Streuungsmikroskopie visualisiert. B: Elektronentomographie und Rekonstruktion einer Herzmuskelzelle (CM) und eines Fibroblasten (FB) in der Infarktrandzone.
- Mechanische Verformung der Ultrastruktur von Herzmuskelzellen - Struktur und Funktion
- Quantitative Analyse des T-tubulären Netzwerks
- Entwicklung neuartiger live-fluoreszierender Ionenindikatoren
- Fibrotischer Umbau bei Fallot’scher Tetralogie
- In vitro Fibrosemodell
- Caceres L [...] Hilgendorf I [...] Rog-Zielinska EA [...]. Molecular mechanisms underlying NLRP3 inflammasome activation and IL-1β production in air pollution fine particulate matter (PM2.5)-primed macrophages. Environ Pollut 2024/341:122997
- Fürniss HE, Wülfers EM, Iaconniani P, Ravens U [...] Kohl P, Rog-Zielinska EA*, Peyronnet R*. Disease severity, arrhythmogenesis, and fibrosis are related to longer action potentials in tetralogy of Fallot. Clin Res Cardiol 2023/epub ahead of print
- Kohl P, Greiner, J, Rog-Zielinska EA. Electron microscopy of cardiac 3D nanodynamics: form, function, future. Nat Rev Cardiol 2022/19(9):607-619
- Jünger F [...] Daller CC, Rog-Zielinska EA [...]. 100 Hz ROCS microscopy correlated with fluorescence reveals cellular dynamics on different spatiotemporal scales. Nat Commun 2022/13(1):1758
- Greiner J, Schiatti T, Kaltenbacher W, Dente M, Semenajakin A, Kok T [...] Ravens U, Kohl P, Peyronnet R, Rog-Zielinska EA. Consecutive-Day Ventricular and Atrial Cardiomyocyte Isolations from the Same Heart: Shifting the Cost-Benefit Balance of Cardiac Primary Cell Research. Cells 2022/11(2):233
- Rog-Zielinska EA, Moss R, Kaltenbacher W, Greiner J, Verkade P, Seemann G, Kohl P, Cannell MB. Nano-scale morphology of cardiomyocyte t-tubule/sarcoplasmic reticulum junctions revealed by ultra-rapid high-pressure freezing and electron tomography. J Mol Cell Cardiol 2021/153:86-92
- Rog-Zielinska EA [...] Peyronnet R, Zgierski-Johnston, Greiner J, Madl J [...] Kohl P. Beat-by-beat cardiomyocyte T-tubule deformation drives tubular content exchange. Circ Res 2021/128:203-215
- MacDonald EA, Madl J, Greiner J […] Rog-Zielinska EA*, Quinn TA*. Sinoatrial node structure, mechanics, electrophysiology and the chronotropic response to stretch in rabbit and mouse. Front Physiol 2020/11:908 (*joint authorship)
- Toomer KA […] Kohl P, Rog-Zielinska EA [...] Norris RA. Primary cilia defects causing mitral valve prolapse. Sci Transl Med 2019/11:eaax0290
- Brandenburg S […] Kohl P, Rog-Zielinska EA, Lehnart SE. Junctophilin-2 expression rescues atrial dysfunction through polyadic junctional membrane complex biogenesis. JCI Insight 2019/4:e127116
- Rog-Zielinska EA [...] Zgierski-Johnston CM […] Kohl P. Species differences in the morphology of transverse tubule openings in cardiomyocytes. Europace 2018/20:120-124
- Kong CHT*, Rog-Zielinska EA*, Kohl P, Orchard CH, Cannell MB. Solute movement in the t-tubule system of rabbit and mouse cardiomyocytes. PNAS USA 2018/115:E7073-E7080 (*joint authorship)
- Rog-Zielinska EA, O'Toole ET, Hoenger A, Kohl P. Mitochondrial Deformation During the Cardiac Mechanical Cycle. Anat Rec 2018/302:146-152
- Scardigli M [...] Rog-Zielinska EA, Kohl P [...] Sacconi L. Quantitative assessment of passive electrical properties of the cardiac T-tubular system by FRAP microscopy. PNAS USA 2017/114:5737-5742
- Brandenburg S [...] Rog-Zielinska EA [...] Kohl P [...] Lehnart SE. Axial tubule junctions control rapid calcium signaling in atria. J Clin Invest 2016/126:3999-4015
- Quinn TA*, Camelliti P*, Rog-Zielinska EA* [....] Kohl P. Electrotonic coupling of excitable and non-excitable cells in the heart revealed by optogenetics. PNAS USA 2016/113:14852-14857 (*joint authorship)
- Rog-Zielinska EA, Johnston CM [...] Kohl P. Electron tomography of rabbit cardiomyocyte three-dimensional ultrastructure. Prog Biophys Mol Biol 2016/121:77-84
- Rog-Zielinska EA, Norris RA, Kohl P, Markwald R. The Living Scar - Cardiac Fibroblasts and the Injured Heart. Trends Mol Med 2016/22:99-114
- Iribe G, Ward CW [...] Kohl P. Axial stretch of rat single ventricular cardiomyocytes causes an acute and transient increase in Ca2+ spark rate. Circ Res 2009/104:787-795
Team

Eva Rog-Zielinska, PhD
Arbeitsgruppenleiterin

Dr. Josef Madl
Senior Scientist
E-Mail: josef.madl@uniklinik-freiburg.de

Leonardo Sacconi, PhD
Senior Scientist

Hannah Kappler

Sofía Orós Rodrigo

Wenzel Kaltenbacher

Wesley Dean Jones




