Qualitätsmanagement

Das Institut für Klinische Pathologie am Universitätsklinikum Freiburg wurde entsprechend der internationalen Norm DIN EN ISO / IEC 17020:2012 als Inspektionsstelle Typ C durch die Deutsche Akkreditierungsstelle GmbH (DAkkS) akkreditiert.
Die Akkreditierung umfasst die innerhalb der Anlage zur Akkreditierungsurkunde D-IS-13134-02-01 aufgeführten Inspektionsprogramme gemäß der dargelegten diagnostischen Untersuchungsverfahren auf Basis der jeweils nachgewiesenen Untersuchungsmethoden.
Neben unseren internen Qualitätsprüfungen beteiligen wir uns kontinuierlich an externen Qualitätsprüfungen in Form von Ringversuchen bei der Qualitätssicherungs-Initiative Pathologie QuIP GmbH.
Wenn Sie Auskünfte und / oder Informationen zu unserem QM-System benötigen oder Sie uns Anregungen oder Rückmeldungen zukommen lassen möchten, stehen wir Ihnen gerne zur Verfügung. Sie können uns entweder über die E-Mail-Adresse des Qualitätsmanagements oder über das Tool der Qualitätsmeldung kontaktieren.
DAkkS-Akkreditierungsurkunde
Die Akkreditierungsurkunde bestätigt die Anforderungen gemäß DIN EN ISO / IEC 17020:2012 für die in der Anlage zu dieser Urkunde aufgeführten Konformitätsbewertungstätigkeiten. Die Anforderungen an das Managementsystem stehen insgesamt in Übereinstimmung mit den Prinzipien der DIN EN ISO 9001.
Anlagen zur Akkreditierungsurkunde
Innerhalb der Anlage zur Akkreditierungsurkunde sind die jeweiligen Inspektionsprogramme / Inspektionsverfahren sowie die akkreditierten Untersuchungsmethoden detailliert dargelegt. Für die in dieser Anlage aufgelisteten Untersuchungsmethoden erfüllt das Universitätsklinikum Freiburg, Institut für Klinische Pathologie, die Anforderungen der DIN EN ISO 15189:2024.
Mitglied des Onkologischen Zentrums
Als Mitglied des Tumorzentrums Freiburg - CCCF wird die Qualität unserer Untersuchungen und die Qualifikation unseres diagnostischen Teams regelmäßig geprüft.
Anlage zum Zertifikat Onkologisches Zentrum
Innerhalb der Anlage zum Zertifikat ist der Geltungsbereich (Tumorentitäten / Organe) des Onkologischen Zentrums dargelegt.
GIST Mutationsanalyse: KIT, PDGFRA (MolPath)
TBC (MolPath)
Defiziente DNA-Mismatch-Repair (dMMR) Split 2
HER2 Magenkarzinom (ISH)
HER2 Magenkarzinom (IHC)
ESP / QuIP Lung Cancer Related Markers - Fusions (MolPath)
KlonML B-Zell Lymphome (MolPath)
KlonML T-Zell Lymphome (MolPath)
Multigen Ringversuch - NGS (NSCLC Marker / nNGM Genpanel)
Multigen Ringversuch - NGS (umfassendes Genpanel > 1 MB)
HRD Ovarialkarzinom (MolPath)
Sarkome: STAT6, Myogenin (IHC)
MLH1 Promotormethylierungsanalyse (MolPath)
EGFR Exon 20 Ins. Liquid Biopsy (NGS)
HRD Ovarialkarzinom (MolPath)
Lymphome - Marker CD20 / CD3 / CD5 / CD23
PIK3CA Breast Cancer Tissue (MolPath)
IDH1 / IDH2 Mutation Analysis in Gliomas (MolPath)
Mammakarzinom: Progesteron-Rezeptor (IHC)
Mammakarzinom: Östrogen-Rezeptor (IHC)
Mammakarzinom: Ki-67 (IHC)
Mammakarzinom: HER2 (IHC)
Mammakarzinom: HER2 Split 4
HPV HNSCC (MolPath)
BRCA1/2 Ovarialkarzinom (MolPath)
Mikrosatelliteninstabilität-PCR (MolPath)
Neuroendokrine Marker: Synaptophysin, Chromogranin, MIB1
BRAF Mutationsanalyse (MolPath)
HPV Zervixkarzinom (MolPath)
MET Exon 14 Skipping NSCLC Gewebe (MolPath)
Mammakarzinom: ER (IHC)
Mammakarzinom: PR (IHC)
Mammakarzinom: Ki-67 (IHC)
Mammakarzinom: HER2 (ISH)
Defiziente DNA-Mismatch-Repair (IHC)
FGFR2 Fusionen Cholangiokarzinom (ISH / NGS)
HER2 Magenkarzinom (IHC)
KlonML B-Zell Lymphome (MolPath)
RAS Mutationsanalyse (MolPath)
KlonML T-Zell Lymphome (MolPath)
RET Fusionen (NGS)
RET Mutationsanalyse (MolPath)
KRAS p.G12C NSCLC (MolPath)
PD-L1 Urothelkarzinom (IHC), CPS & IC
BRCA 1/2 MLH1 Prostatakarzinom (MolPath)
MLH1 Promotermethylierungsanalyse (MolPath)
Lymphome: CD20, CyclinD1, CD5, Kappa, Lambda
HER2-Magen (ISH)
Ki-67 Proliferation
EGFR Liquid Biopsy
HER-2/neu ISH, Mammakarzinom
PIK3CA Mamma Liquid Biopsy
PIK3CA Mamma Gewebe (Molpath)
BRAF V600E Kolon IHC
BRAF V600E Kolon Molpath
HPV-Kopf-Hals
Mikrosatelliteninstabilität-PCR
HPV-Zervix
EGFR Gewebe
FGFR3 Alterationen Urothel
Weitere Zertifikate Ringversuche
Falls von Ihrer Seite weitere bzw. ältere Zertifikate benötigt werden, so bitten wir Sie, Ihre Anfrage an das Qualitätsmanagement unter pat.qm@uniklinik-freiburg.de zu richten. Gerne übermitteln wir Ihnen - wenn möglich - das gewünschte Zertifikat.
Weitere QM-relevante Dokumente und Zertifikate
ERKLÄRUNG nach Art. 5 (5) f) der Verordnung (EU) 2017/746 über In-vitro-Diagnostika zur Eigenherstellung von In-vitro-Diagnostika in Gesundheitseinrichtungen
Universitätsklinikum Freiburg
Department Pathologie und Humangenetik
Institut für Klinische Pathologie
Breisacher Straße 115a
79106 Freiburg im Breisgau
Das Institut für Klinische Pathologie am Universitätsklinikum Freiburg erklärt, dass für diagnostische Untersuchungsverfahren mitunter In-vitro-Diagnostika gemäß Artikel 5, Absatz 5 der Verordnung (EU) 2017/746 über In-vitro-Diagnostika zum Einsatz kommen können, um auf die speziellen Anforderungen und Bedürfnisse von Patient*innen einzugehen.
Sofern in-vitro-Diagnostika zum Einsatz kommen, werden diese ausnahmslos innerhalb des Instituts für Klinische Pathologie am Universitätsklinikum Freiburg verwendet.
Die jeweiligen Produkte (Produktbezeichnung, Produktname) sowie die erforderliche Zweckbestimmung inkl. der Klassifizierung nach Anhang VIII sind innerhalb der Produkt- und Methodenliste dargelegt. Ferner erfüllen diese die geltenden allgemeinen Sicherheits- und Leistungsanforderungen gemäß Anhang I der Verordnung (EU) 2017/746 der In-vitro-Diagnostika.
Das Institut für Klinische Pathologie stellt den jeweils zuständigen Behörden auf Verlangen Informationen und Dokumentationen gemäß Artikel 5, Absatz 5 e) und 5 g) der Verordnung (EU) 2017/746 hinsichtlich in-vitro-Diagnostika in Verbindung mit den relevanten Produkten zur Verfügung.
Falls die geltenden allgemeinen Sicherheits- und Leistungsanforderungen nicht vollumfänglich erfüllt sind, erfolgt eine detaillierte Begründung des Sachverhaltes.
Die einzelnen Fachbereiche des Instituts für Klinische Pathologie am Universitätsklinikum Freiburg erfüllt für alle Untersuchungsmethoden (Makroskopie, Histologie, Zytologie, Immunhistochemie und Immunzytologie sowie der Molekularpathologie) die Anforderungen anhand der gültigen Akkreditierung nach DIN EN ISO / IEC 17020:2012 und der DIN EN ISO 15189:2024.
Nachweis Akkreditierungsurkunde D-IS-13134-02-00
Nachweis Anlage zur Akkreditierungsurkunde D-IS-13134-02-01
Auf Grundlage der Erklärung gemäß der der EU-Verordnung über In-vitro-Diagnostika (EU) 2017/746 werden folgende Dokumente veröffentlicht:
Konformitätserklärung
Erklärung gemäß Art. 5 (5) der IVDR zur Eigenherstellung von In-vitro-Diagnostika in Gesundheitseinrichtungen
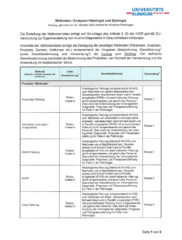
Methodenliste Histologie / Zytologie
Methoden / Analysen Histologie und Zytologie (Auszug, gedruckt am: 20. Oktober 2025)
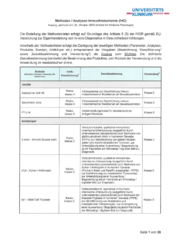
Methodenliste Immunhistochemie (IHC)
Methoden / Analysen Immunhistochemie (Auszug, gedruckt am: 20. Oktober 2025)
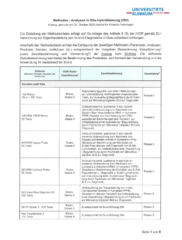
Methodenliste In-situ-Hybridisierung (ISH)
Methoden / Analysen In-situ-Hybridisierung (Auszug, gedruckt am: 20. Oktober 2025)
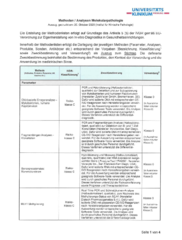
Methodenliste Molekularpathologie (MolPath)
Methoden / Analysen Molekularpathologie (Auszug, gedruckt am: 20. Oktober 2025)
Annex I - Allgemeine Sicherheits- und Leistungsanforderungen
Auszug Anhang I - nicht vollständig erfüllte Anforderungen inkl. Begründung (Auszug, gedruckt am: 20. Oktober 2025)
Das nNGM ist ein Verbund der von der Deutschen Krebshilfe (DKH) geförderten onkologischen Spitzenzentren und universitären Krebszentren , welches die Verbesserung der Versorgung von Lungenkrebspatient*innen durch die flächendeckende Umsetzung personalisierter Therapien auf Basis umfassender molekularpathologischer Diagnostik zum Ziel hat.
Zertifikat NGS-Performance Testung
Anlage NGS-Performance Testung
Freiwillige Qualitätskontrolle der Pathologie in Baden 2019

Prof. Dr. med. Dr. h.c. Martin Werner
Universitätsklinikum Freiburg
Breisacher Straße 115a
79106 Freiburg
Tel.: +49 761 270 80060 (Sekretariat)
Fax: +49 761 270 80040
pathologie.direktion@uniklinik-freiburg.de
Postanschrift:
Postfach 214
79002 Freiburg