Prof. Dr. med. Ulrich Göbel, MBA
Projekt 3Perioperatives Volumenmanagement und hämodynamische Optimierung
Es ist bekannt, dass das perioperative Flüssigkeitsmanagement negative Auswirkungen auf den klinischen Verlauf der Patienten haben kann (sowohl Hyper- als auch Hypovolämie). Der perioperative Verlauf kann aber durch eine zielgerichtete Flüssigkeitsadministration positiv beeinflusst werden kann – hierbei ist nicht unbedingt die Menge der infundierten Flüssigkeit, sondern möglicherweise eher der Zeitpunkt der Therapie entscheidend.
Ziel des perioperativen Volumenmanagements während einer Operation ist es, die Organperfusion und Sauerstoffversorgung aller Gewebe zu sichern und dabei sowohl eine Hypo-, als auch eine Hypervolämie zu vermeiden, da beide Zustände Gefahren bergen.
Im Rahmen einer Hypovolämie ist perioperativ eine Kreislaufinstabilität möglich, welche zu Minderperfusion, Gewebshypoxie und schließlich zur Organdysfunktion führen kann. Mögliche Folgen einer perioperativen Hypoperfusion sind z.B. das akutes, prärenale Nierenversagen. Die Nierendurchblutung beträgt ca. 20-25% des Herzzeitvolumens, daher ist die Nierenfunktion durch eine Verminderung des zirkulierenden Blutvolumens besonders beeinträchtigt. Die Mortalität von Patienten mit einem akuten Nierenversagen beträgt über 40%. Auch andere Organe, wie zum Beispiel die Darmschleimhaut, können durch eine Hypovolämie geschädigt werden und es kann, durch Translokation von Bakterien und Endotoxinen, letztendlich zum Multiorganversagen kommen.
Im Gegensatz dazu kann aus einer Hypervolämie eine Abnahme der funktionellen Residualkapazität der Lunge mit nachfolgendem Lungenödem resultieren. Lungenödeme können wiederum zu dem Syndrom des Acute Lung Injury (ALI) führen, welches nach Lungenparenchymresektionen bei 2 - 7% der Fälle, nach Pneumonektomien sogar bei bis zu 15% der Fälle auftritt. Die Pathogenese des ALI ist bis heute noch nicht vollständig geklärt, die Schädigung der endothelialen Glykokalyx durch Hypervolämie trägt jedoch nach neueren Erkenntnissen vermutlich dazu bei.
Weitere mögliche Folgen einer Hypervolämie sind eine eingeschränkte Pumpfunktion des Herzens und eine verminderte Koronarperfusion, da das Schlagvolumen bei Überschreiten des Volumenoptimums auf der Frank-Starling-Kurve wieder abnimmt. Auch Elektrolytverschiebungen und Ödeme der Darmschleimhaut mit abdominalem Kompartmentsyndrom können aus einer Hypervolämie resultieren.
Es ist die Aufgabe des Anästhesisten, den optimalen Volumenstatus eines Patienten zu ermitteln, herzustellen sowie aufrechtzuerhalten und dabei sowohl eine Hyper- als auch eine Hypovolämie mit ihren jeweiligen Folgen zu vermeiden und das Schlagvolumen des Herzens so anzupassen, dass dem Organismus jederzeit eine suffiziente Auswurfleistung zur Verfügung steht.
Es herrscht keine Einigkeit darüber, welches Konzept die optimale Behandlung darstellt und für die Patienten – abhängig von ihren Grunderkrankungen, Co-Morbiditäten und dem Ausmaß der Operation – den günstigsten klinischen Verlauf bietet. Bisherige Konzepte zur intraoperativen Flüssigkeitssubstitution basieren auf der Berechnung des Basisbedarfs, des Defizitausgleichs und operativ-bedingter Flüssigkeitsverluste. Der Basisbedarf orientiert sich am Körpergewicht und Alter des Patienten, das präoperative Defizit ergibt sich aus der Länge der Nüchternheitsphase vor der Operation und die intraoperativen Flüssigkeitsverluste hängen vom Ausmaß der Operation und eventuellen Blutverlusten ab. Die Flüssigkeitsadministration, welche sich aus diesen Berechnungen ergibt, wird durch die Beurteilung von Parametern wie dem Blutdruck, der Herzfrequenz, der Urinausscheidung und des Hautturgors angepasst.
Neuer ist die Einteilung in „liberale“ und „restriktive“ Volumenregime. Ein „restriktives“ Regime bedeutet eine Flüssigkeitslimitierung. Kommt ein „liberales“ Regime zur Anwendung, wird im Vergleich zur restriktiven Flüssigkeitsgabe eine größere Menge Flüssigkeit infundiert, mit dem Ziel die Organperfusion zu erhöhen. Die Begriffe „liberal" und „restriktiv" sind allerdings nicht fest definiert und werden je nach Institution sehr unterschiedlich ausgelegt – entsprechend uneinheitlich ist die Studienlage.
Durch diese unterschiedlichen Ergebnisse zu den verschiedenen Flüssigkeitsregimen wird deutlich, dass die starre Gabe einer vorgegebenen Flüssigkeitsmenge nach dem Schema „one size fits all“ nicht adäquat ist und jeder Patient eine individuelle Flüssigkeits- und Volumentherapie braucht. So ergibt sich die Frage, anhand welcher Parameter der individuelle Bedarf ermittelt werden sollte.
Die ERAS Gesellschaft hat einen evidenzbasierten Algorithmus mit Hilfe des Ösophagusdopplers zur intraoperativen, hämodynamischen Volumenanalyse und nachfolgender Therapiesteuerung etabliert, welchen wir in unseren klinischen Studien anwenden, um eine individuelle Flüssigkeitstherapie für Patienten bei Hochrisikoeingriffen zu errechnen (siehe Flow-Chart).
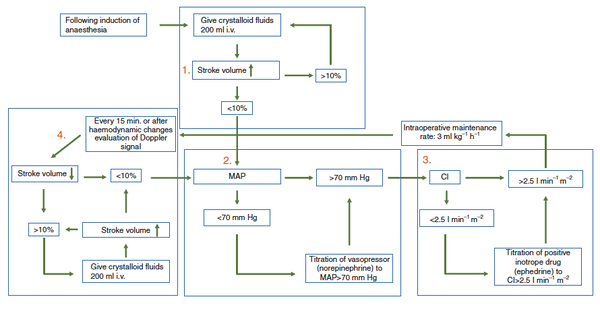
Abbildung addaptiert an: Feldheiser A, Conroy P, Bonomo T, et al. Development and feasibility study of an algorithm for intraoperative goaldirected haemodynamic management in noncardiac surgery. J Int Med Res 2012; 40: 1227–41
Bei dem Ösophagusdoppler (https://www.deltexmedical.com/products/cardioq-odm/) handelt es sich um ein semi-invasives Verfahren, welches mit Hilfe einer dünnen Sonde den aortalen Fluß misst und nach Korrelation mit den invasiv gemessenen Blutdruckwerten weitere Parameter (z.B. Schlagvolumen oder peripherer Widerstand) errechnet. Aufgrund dieser erweiterten Datenlage erfolgt sowohl die Flüssigkeitstherapie, als auch die Katecholamintherapie individualisiert für den speziellen Patienten.
Neben dem Ösophagusdoppler stehen mittlerweile auch komplett nicht-invasive Messverfahren zur Verfügung.
Einige Ergebnisse unserer Arbeitsgruppe zu dieser klinisch relevanten und aktuellen Fragestellung:
Kaufmann K, Baar W, Rexer J, Loeffler T, Heinrich S, Konstantinidis L, Loop T, Buerkle H, Goebel U. Oesophageal Doppler guided goal-directed therapy prevents severe bone cement implantation syndrome in patients undergoing cemented hip arthroplasty – a clinical randomized parallel-arm trial. BMC Anesthesiology (2018) 18:63 doi.org/10.1186/s12871-018-0526-4
Kaufmann K, Stein L, Bogatyreva L, Ulbrich F, Kaifi J, Hauschke D, Loop T, Goebel U. Oesophageal Doppler guided goal-directed therapy reduces postoperative pulmonary complications in patients undergoing lung surgery. Br J Anaesth. 2017 Jun 1;118(6):852-861
Weitere Studien (u.a. zum sog. „Capillary Leaks Syndrom“) bei Patienten, die eine postoperative Intensivtherapie benötigen, sowie retrospektive Analysen sind aktuell im Gange.
Ansprechpartner:
Prof. Dr. Ulrich Göbel
Dr. Kai Kaufmann
Dr. Jakob Wollborn
