Immuntherapie
Immuntherapie im Überblick
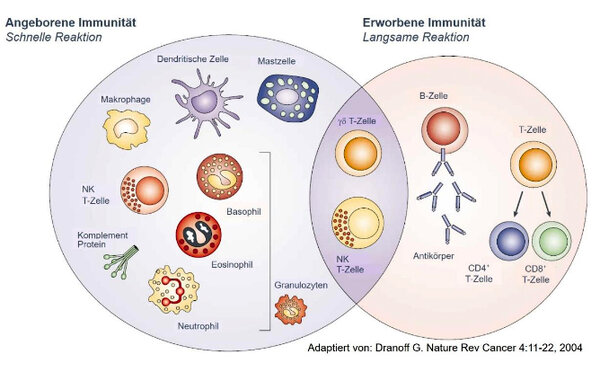
Die Immuntherapie ist eine Form der Krebsbehandlung, bei der das Immunsystem des Patienten hilft, Krebszellen zu zerstören, so wie es Bakterien oder Viren abwehrt. In der Regel werden die Krebszellen nicht direkt mit einem Wirkstoff beeinflusst, sondern die körpereigenen Immunzellen werden dabei unterstützt, Krebszellen zu zerstören. Insofern behandelt Immuntherapie den Körper, und der Körper behandelt den Krebs.
Die Immuntherapie kann ein ganzes Ensemble unterschiedlicher Immunzellen – weiße Blutzellen, die beständig durch Organe und Gewebe zirkulieren – über Wochen und Monate in Aktion versetzen. So kann sich eine nachhaltige therapeutische Wirkung auch gegen versteckte Metastasen entfalten.
Die Idee und klinische Erforschung der Immuntherapie sind über einhundert Jahre alt. Schon um 1890 berichtete der New Yorker Chirurg William Coley nach der Gabe von inaktivierten, fieberproduzierenden Bakterien über bemerkenswerte Heilerfolge bei manchen seiner Krebspatienten (Coley’s mixed bacterial toxins). Spätere Versuche mit Impfstoffen und Immunstimulatoren wiederholten die gelegentlich dramatischen Heileffekte, waren jedoch in Nutzen und Nebenwirkungen zu unberechenbar für eine breite klinische Anwendung.
Erst in den letzten Jahren haben Forscher das detaillierte Zusammenspiel von Krebszellen mit dem Immunsystem, seinen unterschiedlichen Zelltypen, vielfältigen Botenstoffen, potenten Wirkmechanismen und ausgeklügelten Steuerelementen entschlüsselt. Darauf aufbauend ist die Immuntherapie von einer Idee zu einer klinischen Realität geworden.
Gesundheitsbehörden in Europa (EMA), den USA (FDA) und anderen Ländern haben bereits eine Anzahl von Immuntherapie-Verfahren für spezielle Krebsarten zugelassen, unter anderem für schwarzen Hautkrebs (Malignes Melanom), Lungenkrebs, Nierenkrebs und weitere mehr. Viele zusätzliche Wirkstoffklassen und Krebsarten befinden sich in der Phase der klinischen Prüfung.
Welche Form der Immuntherapie?
Nicht alle Formen der Immuntherapie sehen gleich aus oder werden in gleicher Form verabreicht. Stattdessen entwickelt sich eine Vielfalt von Wirkstoffen, Behandlungsverfahren und Anwendungen:
► Immun-Checkpoint Therapie
► allogenen hämatopoetischen Stammzelltransplantation
► Immunzell-basierte Therapie / CAR-T
► Krebsimpfung
► Immunzell-Mediatoren
► Tumorzell-gerichtete Antikörper
Welche dieser Ansätze für welche Patienten geeignet sind, wird durch klinische Prüfungen geklärt, die gegenwärtig für viele Krebsarten durchgeführt werden.
Immun-Checkpoint Therapie
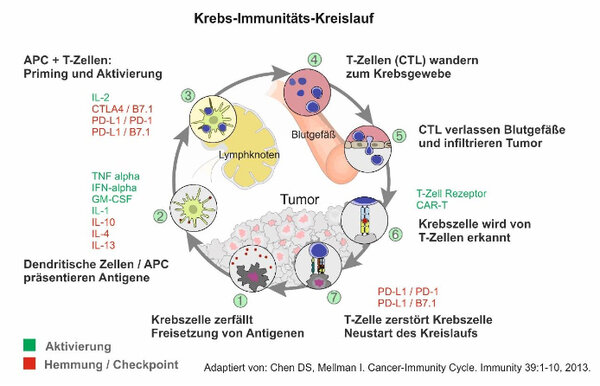
Wenn es zutrifft, dass Immunzellen in der Lage sind, Krebszellen zu erkennen, aufzuspüren und zu zerstören, wieso versagt dieser Schutz in Patienten mit fortschreitender Krebserkrankung? In den letzten Jahren haben Forscher Wege entdeckt, wie sich Krebszellen der Immunabwehr entziehen können. In einer besonders raffinierten Strategie senden die Krebszellen fälschliche Signale zur Checkpoint-Aktivierung aus, so dass die Immunabwehr ausgebremst und abgebrochen wird, bevor sich krebsspezifische Killer T-Zellen überhaupt an ihre Arbeit machen konnten. In einer anderen Strategie erfinden Krebszellen Verschleierungs- und Störsignale, die sie wie eine Tarnkappe gegenüber den Immunzellen unsichtbar machen.
Wissenschaftler und Ärzte haben jedoch herausgefunden, dass die angezogene Handbremse der Checkpoint-Aktivierung in Krebspatienten umkehrbar ist. Es ist ihnen gelungen, Wirkstoffe zu entwerfen – die sogenannten Checkpoint-Blocker – die ihrerseits aktivierte Checkpoints neutralisieren, also die vorzeitig gezogene Bremse lösen und somit den Weg frei machen für die Arbeit der körpereigenen T-Zellen in der Abwehr der Krebszellen.
Da es mehrere Checkpoints gibt, liegt ein großes Augenmerk darauf, für jeden dieser Kontroll- und Bremsmechanismen geeignete monoklonale Antikörper als Checkpoint-Blocker zu entwickeln und diese einzeln oder in Kombination auf klinische Wirksamkeit zu prüfen. Besonders weit fortgeschritten sind diese Untersuchungen für die CTLA-4 und PD-1/PD-L1 Checkpoint-Blocker:
- Der CTLA-4 Checkpoint wird z. B. von dem Wirkstoff Ipilimumab (Yervoy) blockiert.
- Der PD-1 Checkpoint wird z. B. von den Wirkstoffen Pembrolizumab (Keytruda) und Nivolumab (Opdivo) blockiert.
- Der PD-L1 Checkpoint wird z. B. von dem Wirkstoff Atezolizumab (Tecentriq) blockiert.
Bisherige klinische Erfahrungen sprechen für einige Besonderheiten der Behandlung mit Checkpoint-Blockern. Dazu gehören verzögerte und lang-anhaltende therapeutische Effekte, die auf ein immunologisches Gedächtnis der reaktivierten Immunabwehr hinweisen. Beobachtet wird auch das erwartete Profil unerwünschter autoimmunologischer Effekte, die je nach Schweregrad und Lokalisation (z. B. können die Haut, endokrine Organe, Lunge oder Niere unterschiedliche betroffen sein) unterschiedlich behandelt werden können.
allogenen hämatopoetischen Stammzelltransplantation
Für einen Großteil der Patienten mit akuter Leukämie bietet die allogene hämatopoetische Stammzelltransplantation die einzige Chance auf Heilung. Das transplantierte Immunsystem des Spenders vernichtet dabei die Leukämiezellen und entwickelt ein immunologisches Gedächtnis gegen die bösartigen Zellen.
Mehr Information zur allogenen hämatopoetischen Stammzelltransplantation finden Sie hier bzw. auf der Seite der Sektion Allogene Stammzelltransplantation.
Immunzell-basierte Therapie / CAR-T
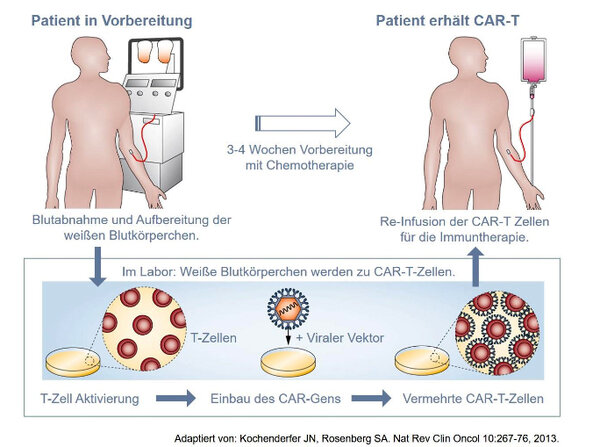
Forscher haben Wege gefunden, Immunzellen von Leukämie-Patienten im Labor derart neu zu programmieren, dass sie anschließend mit erhöhter Wirksamkeit gegen die Krebszellen des ursprünglichen Patienten eingesetzt werden können.
Hierzu werden weiße Blutkörperchen (T-Zellen) aus einer Blutprobe gewonnen und in mehreren Schritten im Labor umprogrammiert, ein Verfahren das etwa 3-4 Wochen in Anspruch nimmt. Ein wesentlicher Schritt ist dabei der Einbau eines neuartigen Gens, welches Bauelemente eines Antikörpers mit Bauelementen eines T-Zell-Rezeptors kombiniert (Chimärer Antigen Rezeptor), in die patienteneigenen (autologen) Zellen. Die so entstehenden CAR-T Zellen können im Labor millionenfach vermehrt werden. Mit einer Infusion erhält der Patient dann seine individuell hergestellte CAR-T Zelltherapie. Diese kann eine besonders hohe Wirksamkeit entfalten, weil sich die CAR-T Zellen im Körper über Wochen weiter vermehren, unermüdlich durch Organe und Gewebe zirkulieren und wiederholt bei direktem Kontakt Krebszellen zerstören, ohne selbst Schaden zu nehmen.
Die klinische Prüfung dieser speziellen Form der Zelltherapie, bei der kein übliches Arzneimittel sondern ein für jeden einzelnen Patienten speziell hergestelltes CAR-T Produkt zum Einsatz kommt, ist besonders weit fortgeschritten für Immunzellen, deren transferiertes CAR-Gen Bauelemente von CD19 Antikörpern enthalten. Damit lassen sich unter anderem CD19+ akute und chronische lymphoblastische Leukämien und spezielle Formen von CD19+ Lymphomen behandeln.
Mit CAR-T Zellen, deren chimäre Rezeptor-Gene anstelle eines CD19 Antikörpermoduls Bauelemente von anderen geeigneten Antikörpern gegen Krebsantigene enthalten, soll dieser therapeutische Ansatz in Zukunft bei weiteren Krebsarten erprobt werden.
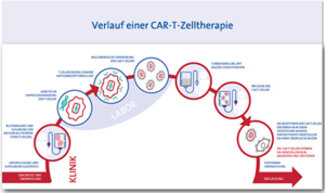
Therapie mit CAR-T-Zellen
Mehr Informationen zur Therapie mit CAR-T-Zellen für Lymphome und Leukämien finden Sie hier.
Krebsimpfung
Die Grundidee einer Impfung ist die Vorbereitung des körpereigenen Immunsystems auf Krankheiterreger vor einer Erkrankung (Prävention). Dies ist von praktischer Bedeutung für Krebserkrankungen, die im Zusammenhang mit speziellen Virusinfektionen entstehen. So führt die Infektion mit dem Hepatitis B Virus (HBV) zu einer Leberentzündung, die auf Dauer ein Wegbereiter für Leberkrebs sein kann. Ähnlich ist die Infektion mit dem Humanen Papillomavirus (HPV) im Kindesalter ein Wegbereiter für die Entstehung von Gebärmutterhals-Krebs und Kopf-Hals-Karzinomen im Erwachsenenalter. Die Einführung wirksamer HBV- und HPV-Impfungen gilt daher als großer Fortschritt in der Prävention entsprechender Krebserkrankungen.
Anders stellt sich die Situation dar, wenn eine Krebserkrankung bereits besteht und keine direkte Verbindung zu einer Viruserkrankung vorliegt. Hierzu gibt es immer wieder Versuche, Krebszellen im Labor künstlich so zu verändern oder in ihre Bauteile zu zerlegen, dass sie besonders markant für das Immunsystem des Patienten erkennbar werden. Nach diesem Konzept erhält ein Patient die veränderten Zellen (oder Bauteile) als Impfstoff zurück (therapeutische Impfung), um nicht nur die veränderten sondern auch die ursprünglichen, wie durch Tarnkappe geschützten, Krebszellen abzuwehren. Bisher gibt es nur einen derartigen, in den USA zugelassenen autologen Krebszell-Impfstoff (Sipuleucel-T) für Patienten mit metastasiertem Prostatakarzinom, der aber in Europa nicht verfügbar ist. Eine große Zahl zusätzlicher Impfstoff-Kandidaten befindet sich weltweit in klinischer Prüfung, um ihren potentiellen therapeutischen Nutzen einzuschätzen.
Immunzell-Mediatoren
Eine Alternative zur Aktivierung des körpereigenen Immunsystems ist in manchen klinischen Situationen die direkte Verabreichung von einzelnen Botenstoffen der Immunzellen (Immun-Mediatoren), welche zumindest vorübergehend Teilaspekte einer Immunabwehr aktivieren können. Hierzu gehören verschiedene Interleukine, Interferone und Knochenmarks-Faktoren.
Beispielsweise kann Interleukin-2 (IL-2) bei Patienten mit Malignem Melanom oder mit metastasiertem Nierenkarzinom zum Einsatz kommen. Interferon-alpha (IFN-α) kann in der Behandlung von Melanomen, Nierenkarzinomen und manchen Leukämien und Lymphomen eingesetzt werden. Colony Stimulating Factors (CSF) helfen dem Knochenmark, die durch Chemotherapie gehemmte Produktion von weißen Blutkörperchen anzukurbeln und so die Infektanfälligkeit während der Behandlung zu mildern.
Tumorzell-gerichtete Antikörper
Unter dem Überbegriff der Immuntherapie von Krebserkrankungen finden sich auch die klinisch bewährten monoklonalen Antikörper, die direkt an der Oberfläche von Krebszellen andocken. Diese Antikörper können das Krebswachstum hemmen, indem sie Wachstums-Signale ins Innere der Krebszellen unterbrechen und indem sie die Krebszellen besonders deutlich für die Erkennung und Zerstörung durch das körpereigene, angeborene Immunsystem markieren. In diesen Fällen werden die therapeutischen Antikörper nicht im Körper gebildet, sondern nach den Bauplänen des menschlichen Immunsystems in hoher Reinheit und Qualität im Labor hergestellt und als konventionelles Arzneimittel verabreicht. Zu den Beispielen gehören monoklonale Antikörper gegen Oberflächenantigene von Brustkrebs (HER2), Darmkrebs (EGFR) und Lymphomen (CD20).
Immuntherapie für jeden?
Neben der Chirurgie, Chemotherapie, Hormontherapie und Strahlentherapie entwickelt sich die Immuntherapie zu einem wichtigen zusätzlichen Angebot der Krebsbehandlung. Je nach Krebsart, Stadium der Erkrankung und spezifischen Merkmalen der Krebszellen und des einzelnen Patienten (Biomarker) ist es wichtig, diese Verfahren in jedem individuellen Behandlungsplan abzuwägen und optimal auszuwählen oder zu kombinieren.
Manche Forscher sind überzeugt, dass mit genügender Ausdauer und medizinischem wie wissenschaftlichem Scharfsinn eine passende Immuntherapie mit durchschlagender Heilkraft und guter Verträglichkeit für jede Krebsart und jeden Krebspatienten erreichbar sei.
In diesem Bestreben kümmert sich die aktuelle immunologische Forschung intensiv um die noch offenen Fragen. Beispielsweise ist unklar, wie viele verschiedene Checkpoint-Blocker in welcher Kombination und für welche Patienten optimal wirksam und hinreichend verträglich eingesetzt werden können. Was unterscheidet Patienten die dauerhaft geheilt werden von denen, die trotz vergleichbarer Behandlung keinen erkennbaren Nutzen ziehen? Welche Behandlung ist möglich, wenn Krebszellen es schaffen, sich für Immunzellen unsichtbar zu machen (Tarnkappen-Effekt) statt Checkpoints zu aktivieren? Erst mit Antworten auf diese Fragen wird das volle Potential der Immuntherapie besser erkennbar werden.
Die jüngsten klinischen Erfahrungen mit den neuen Formen der Immuntherapie, insbesondere den Checkpoint-Blockern oder CAR-T Zellen, sind sehr erfolgversprechend. Sie reichen aber gegenwärtig noch nicht aus, um allgemeine Empfehlungen zum optimalen Einsatz in den verschiedenen Krebsarten, bei unterschiedlichen Stadien der Erkrankung und zugeschnitten auf die Merkmale jedes einzelnen Patienten auszusprechen. Daher ist es für Patienten und behandelnde Ärzte von besonderem Interesse, sich mit spezialisierten Krebszentren zum aktuellen Stand der bereits zugelassenen Immuntherapien und der möglichen Teilnahme an klinischen Studien abzustimmen.
Klinische Studien am Universitätsklinikum Freiburg
Ärzte und Forscher des Universitätsklinikums Freiburg engagieren sich dafür, die besten Immuntherapie-Verfahren bereit zu stellen und bei der klinischen Prüfung neuer immuntherapeutischer Wirkstoffe einen wichtigen Beitrag zu leisten.
Entsprechend bietet das Universitätsklinikum Freiburg seinen Patienten und behandelnden Ärzten Zugang zu den neuen Angeboten der Immuntherapie und die Patienten können, je nach Art ihrer Erkrankung, an klinischen Studien mit potentiell vielversprechenden, neuen immuntherapeutischen Verfahren teilnehmen.
Wir freuen uns über jede Kontaktaufnahme.
Abteilung für Tumorimmunologie und Immunregulation
Mehr Informationen zur Thematik der Immuntherapie finden Sie hier.